Questões UPE 2020 Química com Gabarito Questões de: - Português - Matemática - Física - Inglês - Espanhol - Filosofia - B...
Questões de:
- Português
- Matemática
- Física
- Inglês
- Espanhol
- Filosofia
- Biologia
-
- História
- Geografia
- Sociologia
QUÍMICA
QUESTÃO 11 - UPE 2020 1ª FASE, 2º DIA
(UPE 2020) O mel de abelha é um alimento viscoso, produzido a partir do néctar das flores, que é processado pelas enzimas digestivas desses insetos.
Cerca de 80% em massa da composição do mel é de carboidratos, a saber: 40% de frutose (C6H12O6), 30% de glicose (C6H12O6), 9% de maltose (C12H22O11), 1% de sacarose (C12H22O11), além de 20% de água (H2O).
Qual a massa aproximada de carbono existente em 1 kg de mel de abelha?
Dados: Massas Atômicas – H=1u; C=12u; O=16u
a) 122 g
b) 240 g
c) 322 g
d) 640 g
e) 800 g
GABARITO.
QUESTÃO 12 - UPE 2020 1ª FASE, 2º DIA
(UPE 2020) Quando uma pessoa não tem costume de comer preparos bem apimentados, a sensação é quase sempre a descrita na tirinha a seguir.
A tentativa de solução quase imediata é beber água, o que não é muito efetivo em razão das características da substância, que provoca a ardência, chamada capsaicina.
Essa substância não é solúvel em água, mas apresenta boa solubilidade em gorduras, por isso, para diminuir a sensação de ardor na boca, é mais eficaz tomar um copo de leite integral.
Disponível em: https://www.viciadoempimentas.com.br/curiosidades
Acesso em: jul., 2019.
O que pode ser considerado para explicar essa situação?
a) A polaridade, pois a molécula de capsaicina é apolar, por isso se dissolve bem em gorduras, e não na água.
b) A polaridade, pois a molécula de capsaicina provavelmente é polar, por isso se dissolve bem em gorduras, e não na água.
c) A acidez, pois a molécula de capsaicina é provavelmente ácida, por isso o leite integral, básico é eficiente na neutralização, enquanto a água apenas causará diluição.
d) A basicidade, pois a molécula de capsaicina provavelmente é básica, por isso o leite integral, ácido, é eficiente na neutralização, enquanto a água apenas causará diluição.
e) A densidade, uma vez que o leite integral, por ser mais denso que a água, possui maior potencial para remover as moléculas de capsaicina da boca, o que ajuda a melhorar a sensação de ardor.
GABARITO.
Um feirante foi flagrado por uma emissora de televisão colocando água proveniente de uma galeria de esgoto sobre as bananas que vendia em uma carroça no centro do Recife.
Apesar de existir fiscalização sobre a venda desse tipo de alimentos em espaços livres e mercados, nem sempre os vendedores cumprem as recomendações de segurança alimentar.
A educação sanitária recomenda que as frutas e verduras compradas na rua não sejam só lavadas mas também desinfetadas, de preferência colocando-as em banho com solução aquosa de hipoclorito de sódio, por um período de 10 a 20 minutos.
QUESTÃO 13 - UPE 2020 1ª FASE, 2º DIA
(UPE 2020) Sobre o hipoclorito de sódio, é CORRETO afirmar que se trata de uma substância química
a) iônica, classificada como uma base.
b) covalente polar, classificada como um ácido.
c) iônica, classificada como um sal.
d) covalente apolar, classificada como um sal.
e) iônica, classificada como um ácido.
GABARITO.
QUESTÃO 14 - UPE 2020 1ª FASE, 2º DIA
(UPE 2020) O hipoclorito de sódio pode ser obtido a partir da reação do gás cloro com hidróxido de sódio concentrado, de acordo com a equação química:
Cl2(g) + 2 NaOH(aq) → NaCl(aq) + NaClO(aq) + H2O(l)
Considerando o contexto de uma pequena indústria química, partindo de uma quantidade diária de 50 kg de hidróxido de sódio e volume não limitado de gás cloro, qual a massa de hipoclorito de sódio produzida em 8 dias?
Dados: Massas Atômicas – H=1u; O=16u; Na=23u; Cl=35,5u
a) 372,5 kg
b) 745,0 kg
c) 1303,7 kg
d) 2607,5 kg
e) 1605,5 kg
GABARITO.
QUESTÃO 15 - UPE 2020 1ª FASE, 2º DIA
(UPE 2020) A Organização das Nações Unidas (ONU) proclamou o ano de 2019 como o Ano Internacional da Tabela Periódica dos Elementos Químicos, tornando esse ano especial para a Química.
Ferramenta essencial para o trabalho do químico, a tabela toma por base a lei periódica, a qual afirma que as propriedades dos elementos químicos tendem à repetição sistemática, à medida que aumenta o número atômico. Sobre a tabela periódica, analise as afirmativas seguir:
I. Em um mesmo período da tabela periódica, os elementos dispostos possuem propriedades químicas semelhantes.
II. De maneira geral, as energias de ionização dos elementos do bloco de transição são menores que as energias de ionização dos elementos representativos.
III. A massa atômica de alguns elementos da tabela periódica é fracionária, como o cloro (35,5 u), por causa da presença de diferentes isótopos.
IV. O elemento de número atômico 43 tem o subnível 4d⁵ como o mais energético e encontra-se no quinto período da tabela periódica.
V. O carbono (C, Z = 6) e o selênio (Se, Z = 34) estão na mesma família da tabela periódica.
Estão CORRETAS apenas
a) I, III e IV.
b) II, IV e V.
c) II e V.
d) I, II e V.
e) III e IV.
GABARITO.
QUESTÃO 16 - UPE 2020 1ª FASE, 2º DIA
(UPE 2020) A Revolução Industrial se caracteriza pela mudança no modo de produção, introduzindo a máquina a vapor, entre outras coisas. É um marco importantíssimo na História da humanidade, ocorrido inicialmente, na Inglaterra.
A preocupação com o efeito da emissão sistemática de vapor na atmosfera sobre as condições climáticas fez surgir uma série de estudos, que resultaram na proposição do conceito de pressão parcial e da lei das proporções múltiplas.
Assinale a alternativa que apresenta o nome do autor dos estudos citados acima, que são bases para o modelo atômico que recebeu o seu nome.
a) Bohr
b) Dalton
c) Rutherford
d) Sommerfeld
e) Thompson
GABARITO.
QUESTÃO 17 - UPE 2020 1ª FASE, 2º DIA
Observe as imagens a seguir:
Disponível em: http://qnint.sbq.org.br Acesso em: jul., 2019.
(UPE 2020) Trata-se, respectivamente, de uma representação da molécula de Fulereno (C60) e da estrutura geodésica de Richard B. Fuller, que serviu de inspiração para o seu nome.
Essa substância é popular pela sua semelhança com a bola de futebol, sua beleza estrutural e suas propriedades físicas e químicas.
A relação entre o Fulereno e outras variedades do carbono, como grafite, diamante e nanotubos, ocorre a partir de uma propriedade denominada
a) Isomeria.
b) Isobaria.
c) Isotopia.
d) Alotropia.
e) Semelhança Atômica.
GABARITO.
QUESTÃO 18 - UPE 2020 1ª FASE, 2º DIA
(UPE 2020) O ácido nítrico (HNO3) é amplamente utilizado na indústria química e em laboratório, sobretudo na produção de explosivos e de fertilizantes químicos.
Uma das formas de obtenção desse ácido é a partir do processo de Ostwald, em que a amônia é queimada na presença de platina, formando monóxido de nitrogênio.
Este é oxidado e posteriormente adsorvido em água, conforme as equações a seguir:
4NH3 + 5O2 → 4NO + 6H2O
2NO + → 2NO2
3NO2 + H2O → 2HNO3 + NO
Em determinado experimento controlado, 8,0 gramas de amônia reagem com 10,0 gramas do gás oxigênio.
Quantos gramas de NO são produzidos e qual é o reagente limitante?
Dados: Massas Atômicas – H=1u; N=14u; O=16u
a) São produzidos 4,5 g de NO, e a amônia é o reagente limitante.
b) São produzidos 4,5 g de NO, e o gás oxigênio é o reagente limitante.
c) São produzidos 7,5 g de NO, e o gás oxigênio é o reagente limitante.
d) São produzidos 14,1 g de NO, e a amônia é o reagente limitante.
e) São produzidos 14,1 g de NO, e o gás oxigênio é o reagente limitante.
GABARITO.
QUESTÃO 19 - UPE 2020 1ª FASE, 2º DIA
(UPE 2020) Com a crise hídrica, é cada vez mais comum a utilização de recipientes, como cisternas, caixas d’água, tanques e baldes, tendo em vista a reserva de água potável para as famílias.
Uma preocupação recorrente é manter esses recipientes limpos, pois, com o tempo, há acúmulo de material particulado no fundo desses recipientes.
Assinale a alternativa que apresenta a explicação para o acúmulo do material particulado citado no texto.
a) A água fica parada, e o material particulado decanta, acumulando-se no fundo do recipiente.
b) Durante o armazenamento, há perda de água por evaporação e sublimação do material particulado.
c) O material particulado é formado pela reação entre microorganismos e o cloro usado no tratamento da água.
d) O acúmulo de material no fundo do recipiente deve-se à acidez da água.
e) Ocorre condensação de resíduo sólido por causa da diferença de temperatura entre a estação de tratamento d’água e o reservatório onde a água fica retida em casa.
GABARITO.
QUESTÃO 20 - UPE 2020 1ª FASE, 2º DIA
(UPE 2020) Ao analisar um material sólido, uma cientista produziu um gráfico que relaciona temperatura x tempo, descrevendo o aquecimento desse material. Ao final do experimento, ela concluiu ser o material constituído por uma substância pura.
Assinale a alternativa que apresenta o gráfico produzido pela cientista.





GABARITO.
QUÍMICA
QUESTÃO 11
(UPE 2020) As cólicas menstruais causam muito incômodo para algumas mulheres. Umas, para evitar medicamentos, fazem uso de compressa fria para diminuir a sensação de dor. Nesses casos, deve ser utilizado um material que possa atingir temperaturas baixas, mantendo-as por um longo período.
Normalmente, faz-se uso de bolsas, que são levadas ao congelador e, depois, colocadas na região mais baixa do abdome.
Considerando apenas o aspecto menor temperatura alcançada, assinale a alternativa que apresenta a melhor mistura caseira de preparo de solução a ser colocada na bolsa térmica para ser utilizada com o fim apresentado.
Dados – Massa molar (g/mol): H = 1; C = 12; O = 16; Na = 23; Cl = 35,5
a) 5,0 g de sal de cozinha (NaCl) + 500 mL de água
b) 5,0 g de açúcar (C12H22O11) + 500 mL de água
c) 4,0 g de sal de cozinha (NaCl) + 1,0 g de açúcar (C12H22O11) + 500 mL de água
d) 2,5 g de sal de cozinha (NaCl) + 2,5 g de açúcar (C12H22O11) + 500 mL de água
e) 2,0 g de sal de cozinha (NaCl) + 3,0 g de açúcar (C12H22O11) + 500 mL de água
GABARITO.
QUESTÃO 12
(UPE 2020) Com o agravamento da crise econômica no país, algumas famílias passaram a usar madeira (densidade igual a 0,50 g/cm³) como combustível, em substituição ao GLP – Gás Liquefeito de Petróleo, que é uma mistura dos gases propano (C3H8) e butano (C4H10), comercializado em botijões, contendo 13 kg da mistura.
A madeira é constituída basicamente por celulose e hemiceluloses, tendo calor de combustão igual a 4,0 kcal/g, enquanto o GLP tem calor de combustão igual a 6,0 kcal/g.
Considerando uma família que utiliza toras cilíndricas de madeira, com 10,0 cm de raio e comprimento igual a 25 cm, assinale a alternativa que indica o número de toras que liberaria, nas condições indicadas, aproximadamente, a mesma quantidade de calor fornecida por um botijão de GLP.
Dado: π = 3,14
a) 2,0
b) 3,0
c) 4,0
d) 5,0
e) 6,0
GABARITO.
QUESTÃO 13
(UPE 2020) O conhecimento científico é socialmente construído, e a sociedade deve lutar para que sua destinação seja sempre para beneficiar a coletividade. Os cientistas são pessoas como todas as outras e, portanto, carregam consigo as qualidades e os defeitos que um ser humano pode ter.
Fritz Haber, renomado químico alemão do começo do século XX, é um típico exemplo disso. Ele foi contemplado com o Prêmio Nobel de Química, em 1918, por desenvolver a síntese do gás amônia (NH3) a partir dos gases hidrogênio (H2) e nitrogênio (N2).
Esse processo é fundamental para a produção de fertilizantes e, portanto, de alimentos. Por outro lado, ele também utilizou seu conhecimento para matar milhares de soldados na I Guerra Mundial, num ataque na Bélgica, em 1915, usando gás cloro (Cl2).
As tropas aliadas também fizeram uso de armas químicas durante a I Guerra, matando milhares de soldados adversários. O quadro “Gassed” retrata esse triste momento da história da humanidade.
"Gassed" (1919), de John Singer, retrata o terror do
ataque com gases venenosos na I Guerra
Quanto ao processo descrito e às substâncias apresentadas, são feitas algumas afirmações. Analise-as.
Dado: R = 0,082 atm.L/mol.K
I. Nas CNTPs, a densidade do gás cloro (massa molar 71 g/mol) é igual a 2,50 g/L que é maior que a do ar, fazendo os soldados ficarem imersos em uma nuvem desse gás tóxico.
II. No processo que rendeu o Prêmio Nobel de 1918, o aumento da pressão do sistema desloca o equilíbrio no sentido de formação dos produtos.
III. No ataque promovido na Bélgica, o gás reage com a água contida nos corpos dos soldados (pele, olhos, vias aéreas), dando origem a um equilíbrio químico com a formação dos ácidos clorídrico (HCl) e hipocloroso (HOCl).
Está CORRETO o que se afirma, apenas, em
a) I.
b) III.
c) I e II.
d) I e III.
e) II e III.
GABARITO.
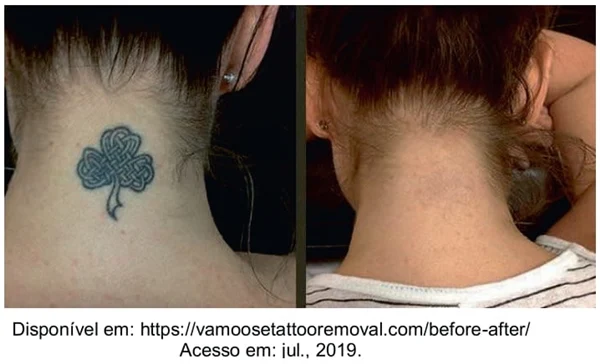
QUESTÃO 14
(UPE 2020) As tatuagens, conhecidas há milênios, são consideradas uma forma de afirmação individual. No entanto, até pouco tempo, fazer uma tatuagem era uma decisão definitiva.
Com o desenvolvimento da Química de Novos Materiais, esse quadro mudou. Há, no mercado, um tipo de tatuagem removível, utilizando-se tintas biodegradáveis. Estas são encapsuladas por um polímero, que pode ser fragmentado, usando-se um laser adequado, quando a pessoa quiser remover a tatuagem.
Após a quebra do polímero, a tinta sofre biodegradação, não sendo mais perceptível quando seu teor é menor que 1,6% no organismo.
Considere um corante que tem meia-vida igual a 8 horas. Após quanto tempo de exposição ao laser, uma tatuagem feita com esse material será totalmente removida?
a) 8 horas
b) 16 horas
c) 1 dia
d) 2 dias
e) 3 dias
GABARITO.
QUESTÃO 15
(UPE 2020) A reação entre o zinco e o ácido clorídrico libera gás hidrogênio, além de formar cloreto de zinco, conforme a equação química:
Zn(s) + 2 HCl(aq) → H2(g) + ZnCl2(aq)
Considerando a mesma temperatura, a mesma quantidade de zinco metálico e o mesmo volume de uma solução ácida, em qual dos sistemas a seguir a reação ocorre mais rapidamente?
Dados – Massa molar (g/mol): H = 1; Cl = 35,5; Zn = 65,4
a) HCl 1,0 mol/L e zinco em barras
b) HCl 0,5 mol/L e zinco em pó
c) HCl 1,0 mol/L e zinco laminado
d) HCl 0,5 mol/L e zinco laminado
e) HCl 0,5 mol/L e zinco em barras
GABARITO.
QUESTÃO 16
(UPE 2020) Uma criança faleceu após ter colocado uma bijuteria na boca. Os peritos que investigavam o caso desconfiaram de uma contaminação por óxido de chumbo (PbO).
Para testar a hipótese, eles dissolveram 20 mg da bijuteria, de forma a obter 10 mL de solução, que foi titulada com H2S, segundo a equação abaixo:
Pb²⁺(aq) + H2S(aq) → PbS(s) + 2 H⁺(aq)
O H2S utilizado na titulação foi produzido a partir de 8,8 mg de sulfeto ferroso (FeS) e ácido clorídrico (HCl) em excesso.
Ele estava contido num recipiente que registrava pressão de 0,0500 atm. Ao final da titulação, a pressão registrada era de 0,0475 atm, sendo mantidos constantes volume e temperatura.
Assinale a alternativa que apresenta o teor aproximado, em massa, de chumbo presente na bijuteria.
Dados – Massa molar (g/mol): H = 1; O = 16; S = 32; Cl = 35,5; Fe = 56; Pb = 207.
a) 0,1%
b) 0,5%
c) 2,5%
d) 5,2%
e) 7,7%
GABARITO.
QUESTÃO 17
(UPE 2020) O Ácido Sulfúrico é um produto químico largamente utilizado pela indústria, sendo uma de suas aplicações mais conhecidas o uso como eletrólito em baterias automotivas.
Nesse tipo de dispositivo, a concentração e o volume da solução ácida é de 5 mol/L e 7,0 L, respectivamente.
Suponha que, para garantir o funcionamento adequado da bateria do seu carro, um estudante de química precisa repor 40% do volume da solução de bateria, tendo, à sua disposição, no laboratório, uma solução concentrada do ácido (M = 18 mol/L).
Dados – Massa molar (g/mol): H = 1; O = 16; S = 32.
Qual volume aproximado do ácido concentrado esse estudante deve tomar?
a) 0,4 L
b) 0,8 L
c) 1,2 L
d) 1,9 L
e) 2,4 L
GABARITO.
QUESTÃO 18
(UPE 2020) Para ser utilizada em um certo processo industrial, o teor de cloretos, a alcalinidade e a dureza da água devem ser menores que 100 mg/L. Para fazer essas determinações, 50 mL de água são titulados com AgNO3 0,01 M, H2SO4 0,01 M e EDTA 0,01 M, respectivamente.
O resultado para cloretos é expresso em miligramas de cloreto por litro de solução, enquanto para alcalinidade e dureza, os resultados são expressos em miligramas de CaCO3 por litro de solução.
Abaixo, são apresentadas as equações balanceadas para cada uma das determinações:
Sabendo que, em I, foram gastos 4,0 mL da solução de AgNO3; em II, foram utilizados 12,0 mL da solução de ácido sulfúrico; e, em III, foram utilizados 6,0 mL da solução de EDTA, o analista preencheu uma tabela, em que o sinal + significa teor acima do limite permitido para a utilização, enquanto o sinal – indica abaixo do limite permitido para uso no processo industrial.
Massa molar (g/mol): C = 12 O = 16 Cl = 35,5 Ca = 40
Assim, assinale a alternativa que apresenta a tabela que foi preenchida pelo analista.

GABARITO.
QUESTÃO 19
(UPE 2020) Sabendo que o KPS do hidróxido de cálcio, Ca(OH)2, a 25ºC é igual a 3,2x10⁻⁵, assinale a alternativa que apresenta o valor da concentração molar de íons hidroxila (OH⁻) numa solução saturada desse hidróxido a 25ºC.
a) 2x10⁻² M
b) 4x10⁻² M
c) 8x10⁻² M
d) 1x10⁻³ M
e) 2x10⁻³ M
GABARITO.
QUESTÃO 20
Observe a imagem a seguir:
(UPE 2020) A luz utilizada para escrever as letras do símbolo do Magnésio (Mg, Z = 12) foi produzida a partir da queima de uma fita desse metal, mediante presença de oxigênio, resultando no óxido de magnésio, conforme a equação a seguir:
2 Mg(s) + O2(g) → 2 MgO(s) ΔH = -1204 kJ
Sobre esse processo, são feitas quatro afirmações:
I. A reação ocorre mediante liberação de energia, portanto é exotérmica.
II. A queima de 4 gramas de fita de magnésio libera 90,5 kJ de energia.
III. Para a produção de 30 gramas de óxido de magnésio, são liberados 451,5 kJ de energia.
IV. A variação de entalpia é negativa, portanto a reação é não espontânea.
Dados – Massa molar (g/mol): O = 16; Mg = 24.
Estão CORRETAS apenas
a) I e III.
b) II e III.
c) I, II e IV.
d) II, III e IV.
e) I, III e IV.
GABARITO.
QUÍMICA
QUESTÃO 11
(UPE 2020) A demanda por fraldas tem aumentado ao longo dos anos. Com isso, o debate sobre a melhor utilização de fraldas descartáveis (à base de polietileno e poliacrilato de sódio) ou de tecidos (à base de algodão) é recorrente. É importante considerar alguns aspectos da natureza química desses materiais.
A seguir, são apresentadas as estruturas dos compostos bem como algumas informações sobre esses tipos de fralda indicados no texto:
Sobre essa temática, analise as afirmativas a seguir:
I. As fraldas descartáveis e de tecido são constituídas por polímeros.
II. O polissacarídeo apresentado é o principal constituinte dos tecidos à base de algodão.
III. O polietileno, por ser hidrofóbico, é utilizado para reter os líquidos e impedir o vazamento.
IV. O poliacrilato, por ser polar, naturalmente se degrada em pouco tempo, causando impactos ambientais irrelevantes.
V. O poliacrilato de sódio é um material hidrofílico, utilizado tanto em fraldas quanto em absorvente íntimo feminino, para reter biofluidos aquosos.
Estão CORRETAS apenas
a) I, II e IV.
b) I, III e V.
c) I, II, III e V.
d) I, III, IV e V.
e) II, III, IV e V.
GABARITO.
QUESTÃO 12
(UPE 2020) Um designer de joias solicitou a um de seus fornecedores que depositasse, eletroquimicamente, uma camada de 1,97 g de ouro sobre uma peça por ele produzida. Segundo o fornecedor, o processo demoraria aproximadamente 10 minutos, usando uma corrente de 5,0 A e solução de cloreto de ouro III.
O designer acompanhou o processo e verificou que a corrente elétrica e o tempo empregado foram os indicados pelo fornecedor. No entanto, ao chegar ao seu atelier, percebeu que o incremento de massa na peça foi de apenas 0,27 g, tendo reclamado ao fornecedor que reconheceu o erro e afirmou ter sido utilizada uma solução contendo íon crômio na eletrodeposição.
Dados: Massa molar do Cr = 52 g/mol; Constante de Faraday = 96500 C/mol
Assinale a alternativa que apresenta a espécie utilizada no processo.
a) Cr²⁺
b) Cr³⁺
c) Cr⁴⁺
d) Cr⁵⁺
e) Cr⁶⁺
GABARITO.
QUESTÃO 13
(UPE 2020) Óleos essenciais são normalmente extraídos a partir de plantas medicinais, sendo seu uso como antimicrobiano amplamente difundido.
Abaixo, são apresentados dados da composição de óleos essenciais de Citronela, Eucalipto, Lavanda e Melaleuca e, ao lado, as estruturas desses compostos.
Quanto à composição química dos óleos essenciais apresentados, analise as afirmativas a seguir:
I. O óleo essencial de lavanda tem como componente majoritário um álcool.
II. Os componentes majoritários dos óleos de melaleuca e de citronela são isômeros.
III. Os dois componentes majoritários do óleo de lavanda possuem isômeros ópticos.
IV. O componente comum nos óleos de eucalipto e de melaleuca possui um centro estereogênico.
V. O óleo de eucalipto difere dos outros por apresentar, apenas, hidrocarbonetos como compostos majoritários.
Estão CORRETAS
a) I, II e IV.
b) I, III e V.
c) II, III e V.
d) II, IV e V.
e) III, IV e V.
GABARITO.
QUESTÃO 14
(UPE 2020) Teoricamente uma célula nervosa pode ser tratada como célula eletroquímica, pois a concentração de íons K⁺ é diferente quando consideramos os fluidos interno e externo à célula.
Sabese que a concentração de íons K⁺ no interior da célula é 20 vezes maior que a concentração desse mesmo íon no fluido externo à célula.
Considerando, apenas, os aspectos indicados, assinale a alternativa que apresenta a diferença de potencial da célula nervosa.
a) 13 mV
b) 26 mV
c) 52 mV
d) 78 mV
e) 91 mV
GABARITO.
QUESTÃO 15
(UPE 2020) Numa certa empresa de reciclagem, o processo inicia-se por meio da separação dos polímeros em função de suas densidades (d).
Na sequência, caso o material seja uma poliolefina, é submetido à pirólise à baixa temperatura; caso seja poliéster ou poliamida, é submetido à hidrólise ou metanólise (reação com metanol); caso sejam polímeros de unidades monoméricas mais complexas que as citadas, são submetidos à pirólise catalisada e com temperaturas elevadas.
A seguir, têm-se um fluxograma de processo e as estruturas desses polímeros – PET (Polietileno tereftalato), PEBD (Polietileno de baixa densidade), PP (Polipropileno), PVC (Policloreto de vinila) e PS (Poliestireno).
Quanto ao processo descrito, assinale a alternativa CORRETA.
a) O decantado II possui, apenas, um polímero.
b) O decantado II foi submetido à pirólise catalisada à alta temperatura.
c) O decantado I é uma mistura binária contendo um poliéster e uma poliolefina.
d) O sobrenadante I é uma mistura de polímeros que foi submetida à metanólise.
e) O sobrenadante I e a fração que contém o PET foram submetidos ao mesmo tratamento.
GABARITO.
QUESTÃO 16
(UPE 2020) Três hidrocarbonetos insaturados foram submetidos à Ozonólise, conforme representação ao lado:
Assinale a alternativa que apresenta, respectivamente, o nome dos compostos A, B e C.
a) Butanona / Butanal / Etanal
b) Metanal / Butanona / Propanal
c) Propanona / Propanal / Etanal
d) Propanona / Butanona / Propanal
e) Metanal / Ácido Metiletanoico / Propanona
GABARITO.
QUESTÃO 17
(UPE 2020) Um dos mais importantes hospitais do litoral paulista foi investigado em 2009, sob suspeita de ter simulado tratamentos de radioterapia oferecidos a pacientes com câncer.
O Ministério Público Estadual (MPE) apurou que pelo menos sete doentes passaram pelo chamado acelerador linear - dispositivo que emite feixes de radiação sobre a área afetada - período em que o aparelho estava quebrado.
Em depoimento, uma técnica do setor de radioterapia confirmou a prática e disse ter recebido ordens para ludibriar os pacientes, que teriam partido de um dos médicos que, desde 1986, era um dos responsáveis pela unidade de radioterapia. Os pacientes tratados nessa unidade foram relocados para outros hospitais.
A unidade está fechada desde julho de 2009, quando surgiram as primeiras denúncias de que um dos equipamentos de radioterapia funcionava com a bomba de cobalto (fonte de radiação) vencida há dois anos.
A direção do hospital abriu sindicância para apurar os indícios de irregularidades no atendimento aos pacientes e se comprometeu a repassar ao Ministério Público (MP) as informações coletadas. "Estamos estarrecidos com o que aconteceu", disse o diretor técnico do hospital.
(SILVA, 2013, adaptado de “O Estado de S. Paulo”, 29.10.2009
Disponível em: http://www.estadao.com.br/noticias/geral,em-
santos-hospital-e-acusado-desimular-radioterapia,458297,0.htm)
Acesso em: ago., 2019.
Sobre o texto, analise as afirmativas a seguir:
I. Afirmar que a bomba de cobalto estava vencida significa que, em razão do tempo de meia-vida, ocorre uma diminuição na dose efetiva de exposição, tornando o procedimento ineficaz.
II. O equipamento se tornaria eficiente para o tratamento radioterápico se as pastilhas de cobalto radioativo fossem substituídas por novas pastilhas.
III. Embora a bomba de cobalto estivesse vencida, o equipamento poderia continuar sendo utilizado, sem prejuízo para o paciente, desde que o período de exposição fosse ampliado.
IV. Para tornar o equipamento novamente efetivo, as pastilhas vencidas deveriam ser irradiadas, recuperando o seu potencial para o tratamento radioterápico.
Estão CORRETAS
a) I e II.
b) I e III.
c) II e III.
d) I e IV.
e) II e IV.
GABARITO.
QUESTÃO 18
(UPE 2020) Na série Dark, da Netflix, um dos acontecimentos que guia a trama é a desativação da usina nuclear de Widen, uma cidade alemã.
Existem três formas de desativação de uma usina nuclear:
(1) Desmantelamento, quando as partes do reator são removidas e levadas para descontaminação após fechamento da usina, sendo depositadas no fundo do mar;
(2) Armazenamento Seguro, que consiste em manter a usina selada, até que os radionuclídeos tenham sua atividade radioativa reduzida a níveis seguros;
(3) Sepultamento, quando a unidade é encapsulada em um domo de concreto e aço.
Considerando o aspecto segurança dos moradores da cidade, assinale a alternativa que apresenta a opção CORRETA para a desativação dessa usina e a razão para essa escolha.
a) (1), uma vez que evitaria que o material radioativo permanecesse em Widen, após a desativação da usina.
b) (2), porque evitaria que as partes do reator pudessem influenciar a vida marinha.
c) (3), pois as placas de concreto e aço impedem a propagação da radiação, constituindo-se em única opção totalmente segura.
d) (2) ou (3), porque são igualmente seguras, devendo ser escolhida aquela que tiver menor custo operacional.
e) (1) ou (2), uma vez que, em (3), há o risco de vazamento radioativo, pois o concreto pode apresentar desgaste ao longo dos anos.
GABARITO.
QUESTÃO 19
(UPE 2020) Em uma brincadeira com seus amigos na rua, Paulo foi atacado com jambos, ficando com a camisa manchada.
Com medo de ser repreendido pela mãe, tentou lavar suas roupas com água, e nada aconteceu. Com receio, mostrou a blusa a sua mãe que lavou com sabão e, para surpresa de Paulo, a camisa ficou completamente limpa.
Assinale a alternativa que apresenta a explicação CORRETA para o fenômeno descrito.
a) Ocorreu uma reação chamada saponificação entre a sujeira e a água, com o sabão agindo como ativador.
b) Houve uma reação chamada saponificação entre a água e o sabão que é capaz de retirar toda a sujeira.
c) Ocorreu uma reação chamada saponificação entre a sujeira e o sabão que é capaz de retirar toda a sujeira.
d) O sabão usado pela mãe de Paulo tinha uma parte hidrofílica, que é solúvel em água, e outra hidrofóbica, que faz a mancha desaparecer.
e) O sabão usado pela mãe de Paulo tinha uma parte hidrofóbica que é solúvel em água, e outra hidrofílica, que faz a mancha desaparecer.
GABARITO.
QUESTÃO 20
(UPE 2020) O mentol é um composto orgânico ceroso, cristalino, de coloração branca, que apresenta propriedades anestésicas e anti-inflamatórias.
Sobre esse composto, é CORRETO afirmar que ele possui
a) três centros estereogênicos, consequentemente quatro pares de estereoisômeros, com propriedades químicas diferentes.
b) dois centros estereogênicos, consequentemente dois pares de estereoisômeros, com as mesmas propriedades químicas.
c) três centros estereogênicos, consequentemente três estereoisômeros, com as mesmas propriedades químicas.
d) um único centro estereogênico, consequentemente dois estereoisômeros, com as mesmas propriedades químicas.
e) dois centros estereogênicos, consequentemente dois pares de estereoisômeros, com propriedades químicas diferentes.
GABARITO.








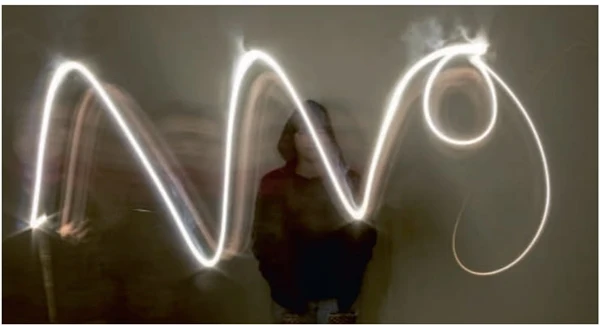















COMENTÁRIOS