Prova de Química ENADE 2008 com Gabarito
Prova de Química ENADE 2008 com Gabarito
OBS: As questões objetivas de 01 a 08 estão disponível na prova de Formação Geral que você pode acessar clicando neste link. As questões discursivas não foram disponibilizadas com padrão de resposta.
ENADE 2008 - QUESTÃO 11
O íon complexo [Co(en) 2 Cl2 ] ⁺ , no qual en representa o ligante etilenodiamino, possui dois isômeros geométricos (cis/trans) e um par de enantiômeros (d ,l ). Quando tratado com solução diluída de NaOH, o diclorocomplexo sofre hidrólise alcalina, convertendo-se no hidroxocomplexo [Co(en) 2 Cl(OH)]⁺. Quantos isômeros geométricos (cis/trans) e quantos pares de enantiômeros (d ,l ) podem existir para o hidroxocomplexo?

ENADE 2008 - QUESTÃO 12
To prepare the Cr (VI) oxoanion, chromite ore, FeCr2 O4 , which contains Fe (II) and Cr (III), is dissolved in molten potassium hydroxide and oxidized with atmospheric oxygen. In this process, the iron and chromium, respectively, are converted to FeO4 ²⁻ and CrO4 ²⁻ , so chromium reaches its maximum oxidation state (equal to the group number) but iron does not. Dissolution in water followed by filtration leads to a solution of the two oxoanions. The ions can be separated by taking advantage of the greater oxidizing power of Fe (VI) relative to that of Cr (VI) in acidic solution. Acidification leads to the reduction of FeO4 ²⁻and the conversion of CrO4 ²⁻ to dichromate Cr2 O7 ²⁻ ; the latter conversion is a simple acid-base reaction, and not redox reaction.
SHRIVER, D.F.; ATKINS, P. Inorganic Chemistry.
Oxford: Oxford University Press, 1996.
A partir da interpretação do texto, conclui-se que
(A) os oxoânions FeO4 ²⁻e CrO4 ²⁻ podem ser separados por filtração.
(B) o ferro se reduz, quando o cromo atinge seu número de oxidação máximo.
(C) o maior poder oxidante do FeO4 ²⁻ leva à oxidação do cromo, em solução ácida.
(D) uma solução contendo o oxoânion FeO4 ²⁻ não é estável em meio ácido.
(E) um oxoânion de Cr (VI) é utilizado para preparar a cromita por dissolução em KOH e oxidação com ar atmosférico.
ENADE 2008 - QUESTÃO 13
Várias espécies atômicas ou moleculares podem ser responsáveis pela redução da camada de ozônio na estratosfera. A figura abaixo representa a evolução de algumas espécies encontradas na estratosfera, acima do Ártico, durante o inverno e a primavera, bem como algumas das reações que ocorrem nesse sistema.

BAIRD, C.; CANN, M. Environmental Chemistry.
New York: W. H. Freeman and Company, 2005. p.44. (com adaptação)
Qual das espécies abaixo é responsável pela etapa de destruição do O3 , segundo o mecanismo apresentado na figura?
(A) NO
(B) Cl
(C) O
(D) ClO
(E) Cl2 O2
ENADE 2008 - QUESTÃO 14
Antibióticos antifúngicos foram produzidos a partir de quatro cepas distintas de microrganismos da microbiota brasileira, tendo sido isolados derivados que apresentam estruturas contendo desde macrociclos tetraênicos (ciclos com quatro duplas conjugadas) até macrociclos heptaênicos.
Após cultivo dos microrganismos em meios de cultura apropriados, procedeu-se à extração com metanol, e os filtrados (FI a FIV) foram analisados por espectrometria na região do ultravioleta-visível, fornecendo os seguintes máximos de absorção:
F I: 291, 304 e 308 nm
F II: 340, 358 e 380 nm
F III: 317, 331 e 350 nm
F IV: 363, 382 e 405 nm
Sabendo-se que cada cepa produz um único tipo de macrociclo, a associação entre o filtrado e o tipo de macrociclo ocorre na relação:
(A) FI – tetraênico; FIII – pentaênico.
(B) FI – heptaênico; FIII – hexaênico.
(C) FI – hexaênico; FIV – heptaênico.
(D) FII – pentaênico; FIII – hexaênico.
(E) FII – tetraênico; FIV – pentaênico.
ENADE 2008 - QUESTÃO 15
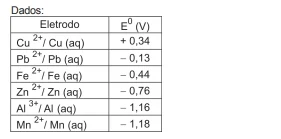
Cada vez mais busca-se desenvolver novos processos para obtenção de metais de modo a minimizar o consumo de energia, viabilizar a exploração econômica de minérios com baixos teores de metal e evitar maiores problemas ambientais decorrentes da produção de SO2 . Atualmente, minérios de cobre - calcopirita (CuFeS2 ), calcocita (Cu2 S) - com baixos teores desse metal não são extraídos pela técnica convencional de calcinação seguida de redução com carvão (pirometalurgia).
Emprega-se o processo hidrometalúrgico de lixiviação, que consiste no uso de uma solução aquosa capaz de dissolver o composto que contém o metal a ser extraído. Após a lixiviação do minério com solução diluída de ácido sulfúrico, cobre metálico é precipitado pela redução dos íons Cu ²+ com raspas de ferro.
Considere os seguintes minérios e seus principais constituintes (escritos entre parentêses):
galena (PbS)
wurtizita (ZnS)
pirita (FeS2 )
pirolusita (MnO2 )
bauxita (Al2 O3 . xH2 O)
Desconsiderando as impurezas que possam estar presentes, qual dos metais citados pode ser obtido pelo processo de lixiviação ácida seguida de redução com raspas de ferro?
(A) Fe
(B) Zn
(C) Pb
(D) Mn
(E) Al
ENADE 2008 - QUESTÃO 16
A determinação do teor de ClO ¹−em amostras comerciais de alvejantes à base de hipoclorito de sódio pode ser feita por titulometria de oxidação-redução, utilizando um método indireto, conduzido em meio ácido e baseado na seguinte reação:

Para proceder a essa análise, é necessária a utilização dos reagentes abaixo, EXCETO
(A) Solução padrão de tiossulfato de sódio.
(B) Solução padrão de iodo.
(C) Solução de ácido acético glacial.
(D) Iodeto de potássio.
(E) Suspensão de amido recém-preparada.
ENADE 2008 - QUESTÃO 17
A cloração de tolueno pode gerar produtos distintos em função das condições reacionais. Abaixo são apresentados dois espectros de RMN de hidrogênio correspondentes aos produtos isolados de duas reações de cloração de tolueno.
Analisando os espectros de RMN dos produtos obtidos, conclui-se que o
(Observação: a tabela com as faixas características de deslocamento químico encontra-se ao final deste caderno.)
(A) simpleto na região de 7,4 ppm no espectro de RMN de ¹H do produto P1 corresponde aos hidrogênios do anel aromático monossubstituído.
(B) simpleto na região de 4,5 ppm indica que o produto P1 foi obtido via mecanismo de substituição eletrofílica.
(C) espectro de RMN de ¹H do produto P2 indica que ele foi obtido por cloração em presença de luz ultravioleta.
(D) produto P1 pode ser isolado do meio reacional por extração com solução aquosa de NaOH.
(E) produto P2 foi obtido via mecanismo de substituição nucleofílica aromática.
ENADE 2008 - QUESTÃO 18
Um movimento ecológico preocupado com as condições da água de um rio situado em uma área de grande aglomeração urbana resolve fazer uma campanha para conscientizar a população a utilizar detergentes em pó com parcimônia.
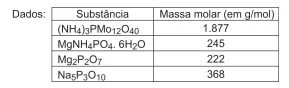
Para tal, encomenda a uma empresa que analise o teor de fósforo em amostras de detergentes em pó de três fabricantes da região, os quais contêm tripolifosfato de sódio, Na5 P3 O10, utilizado para promover o abrandamento da dureza das águas.
O teor de fósforo no detergente em pó foi determinado por gravimetria. O método consiste em tratar a amostra com excesso de molibdato de amônio, precipitando o fósforo na forma de (NH4 ) 3 PMo12O40. O precipitado lavado e livre de interferentes é dissolvido em solução de NH3(aq) e reprecipitado como MgNH4 PO4 . 6 H2 O, que, sob calcinação, se converte em pirofosfato de magnésio, Mg2P2O7(s).
A análise em triplicata forneceu os seguintes resultados:
Sabendo que a Resolução do CONAMA estabelece o valor de 4,80% como limite máximo de fósforo no produto, o(s) fabricante(s) que forneceu(ram) amostra(s) em conformidade com esta Resolução é(são) APENAS
(A) I
(B) II
(C) III
(D) I e II
(E) II e III
ENADE 2008 - QUESTÃO 19
A estévia é um adoçante obtido da planta Stevia rebaudiana, que cresce naturalmente no Brasil. A partir da estévia pode-se obter o esteviol, segundo a reação abaixo, na qual G representa uma unidade de glicose.
Após a reação, a mistura reacional foi neutralizada. Qual dos métodos abaixo é indicado para recuperar o esteviol do meio reacional?
(A) Destilação fracionada
(B) Extração com acetato de etila
(C) Precipitação com carbonato de sódio
(D) Cromatografia gasosa de alta resolução
(E) Cromatografia em camada delgada utilizando sílica como adsorvente
ENADE 2008 - QUESTÃO 20
Uma fonte de radiação estelar na faixa de comprimento de onda do visível emite radiação como um corpo negro perfeito.
A sua radiação é avaliada por três observadores distintos: (X) observa diretamente a radiação emitida e (Y) observa a radiação transmitida através de uma massa de gás interestelar fria.
O terceiro observador, (Z), analisa a radiação emitida pela mesma massa de gás. Com base nos relatos dos observadores, foram feitas as seguintes afirmações:
I - o espectro da radiação observada por (X) possui linhas e bandas características da fonte;
II - o espectro observado por (Y) apresenta linhas escuras sobre um contínuo multicolorido;
III - os espectros observados por (Y) e (Z) dependem da natureza do gás;
IV - transições eletrônicas são responsáveis pelas linhas brilhantes no espectro observado por (Z).
São corretas APENAS as afirmações
(A) I e II
(B) I e IV
(C) III e IV
(D) I, II e III
(E) II, III e IV
ENADE 2008 - QUESTÃO 21
A reabsorção é uma característica desejada para uma biocerâmica em alguns tipos de implantes ósseos, em que o processo de dissolução é concomitante com o de precipitação. Quando a biocerâmica é a hidroxiapatita – Ca10(PO4 ) 6 (OH)2 – a velocidade de reabsorção aumenta com o aumento da área superficial, com o decréscimo da cristalinidade e com a substituição parcial de íons fosfato por íons carbonato e de íons Ca²⁺ por íons Sr²⁺.
Existe uma estreita relação entre as propriedades do biomaterial e seu método de preparação. Considere as afirmações a seguir, feitas a respeito da dependência da capacidade de reabsorção de uma hidroxiapatita com variáveis experimentais de sua preparação por precipitação em meio aquoso.
I - Depende do tamanho das partículas e, portanto, depende da temperatura em que é conduzida a reação.
II - Depende da porosidade do material e, portanto, depende da temperatura de sinterização.
III - Independe da composição química do material e, portanto, íons cálcio e fosfato podem ser substituídos.
Está(ão) correta(s) a(s) afirmação(ões)
(A) I, apenas.
(B) I e II, apenas.
(C) I e III, apenas.
(D) II e III, apenas.
(E) I, II e III.
ENADE 2008 - QUESTÃO 22
Para átomos hidrogenóides, a quantização dos níveis de energia é dada por:  , onde Z é o número atômico, e é a carga do elétron, n é o número quântico principal e ao é o Raio de Bohr. Sabendo-se que, na presença de um campo magnético externo, o diagrama de energia de átomos hidrogenóides sofre alteração, qual é a degenerescência máxima observada no nível n=3, nessa condição?
, onde Z é o número atômico, e é a carga do elétron, n é o número quântico principal e ao é o Raio de Bohr. Sabendo-se que, na presença de um campo magnético externo, o diagrama de energia de átomos hidrogenóides sofre alteração, qual é a degenerescência máxima observada no nível n=3, nessa condição?
 , onde Z é o número atômico, e é a carga do elétron, n é o número quântico principal e ao é o Raio de Bohr. Sabendo-se que, na presença de um campo magnético externo, o diagrama de energia de átomos hidrogenóides sofre alteração, qual é a degenerescência máxima observada no nível n=3, nessa condição?
, onde Z é o número atômico, e é a carga do elétron, n é o número quântico principal e ao é o Raio de Bohr. Sabendo-se que, na presença de um campo magnético externo, o diagrama de energia de átomos hidrogenóides sofre alteração, qual é a degenerescência máxima observada no nível n=3, nessa condição?(A) 0
(B) 1
(C) 3
(D) 9
(E) 12
ENADE 2008 - QUESTÃO 23
A determinação de cloretos solúveis pode ser feita por gravimetria, precipitando-se AgCl (s) pela adição de excesso de solução de AgNO3 . Para quantificar a massa de AgCl, torna-se necessário promover a coagulação do sistema coloidal formado.
Qual das ações listadas abaixo contribui para desestabilizar o AgCl coloidal, permitindo realizar a análise gravimétrica?
(A) Adicionar um eletrólito ao sistema.
(B) Adicionar um agente nucleador ao meio.
(C) Adicionar a solução de AgNO3 rapidamente ao meio.
(D) Resfriar o sistema após a adição da solução de AgNO3.
(E) Manter o sistema em repouso durante a adição da solução de AgNO3.
ENADE 2008 - QUESTÃO 24
A 700 °C e 1 atm, a constante de equilíbrio para a reação C(s,graf) + H2O (g) → CO (g) + H2 (g) é igual a 1,6.
Nessas condições, ao atingir o equilíbrio, qual a fração molar aproximada de hidrogênio na fase gasosa?
(A) 0,12
(B) 0,26
(C) 0,33
(D) 0,44
(E) 0,55
ENADE 2008 - QUESTÃO 25
O Processo Haber-Bosch para produção de amônia se baseia na redução catalítica do N2 pelo H2 sob altas pressões. Uma das alterações introduzidas no Processo Haber-Bosch foi a utilização do CH4 como fonte de H2.
A reação catalisada entre CH4 e vapor d’água gera H2, CO e CO2 . Depois das etapas de purificação, traços de CO, que poderiam envenenar o catalisador à base de ferro, são retirados sobre um catalisador de Ni, que leva o CO a CH4 em presença de H2. A lei de velocidade dessa reação é:  , onde Pi é pressão parcial, k é a velocidade específica e b é uma constante positiva.
, onde Pi é pressão parcial, k é a velocidade específica e b é uma constante positiva.
 , onde Pi é pressão parcial, k é a velocidade específica e b é uma constante positiva.
, onde Pi é pressão parcial, k é a velocidade específica e b é uma constante positiva.A respeito desse sistema, foram feitas as seguintes afirmações:
I - a formação da amônia a partir dos reagentes em seus estados padrões é um processo espontâneo;
II - na formação da amônia, o aumento da temperatura desloca o equilíbrio na direção dos produtos;
III - a reação de conversão de CO em metano é de primeira ordem com relação ao CO;
IV - na conversão de CO em metano, o aumento da concentração de H2 acelera a reação.
São corretas APENAS as afirmações
(A) I e II
(B) I e III
(C) II e III
(D) II e IV
(E) III e IV
ENADE 2008 - QUESTÃO 26
As lipases são enzimas capazes de catalisar a reação de bio-transformação dos triésteres de glicerol presentes nos óleos vegetais com álcool etílico, produzindo monoésteres de etanol, o “biodiesel brasileiro”.
Abaixo é apresentado um gráfico qualitativo da variação da concentração com o tempo de reação, obtido na bio-transesterificação do triexadecanoato de glicerila com etanol, catalisada por lipase.
Sobre o comportamento dessa reação e sua curva cinética, foram feitas as seguintes afirmativas:
I - as curvas 1, 2, 3 e 4 representam as variações das concentrações dos produtos formados ao longo da reação;
II - a curva 5 representa a variação da concentração do triéster de glicerol com o tempo de reação;
III - a curva 4 representa a variação da concentração do glicerol formado na reação;
IV - a curva 1 representa a variação da concentração de hexadecanoato de etila com o tempo de reação.
Estão corretas APENAS as afirmativas
(A) I e II
(B) I e III
(C) II e III
(D) II e IV
(E) III e IV
ENADE 2008 - QUESTÃO 27
A Célula de Weston, representada abaixo, foi usada durante muitos anos como padrão de potencial devido à reprodutibilidade do valor de seu potencial (1,0180 V a 25 °C).
(A) a reação anódica é: 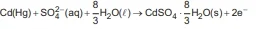
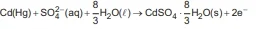
(B) a reação catódica é:Cd²⁺ (aq) + 2e⁻ → Cd(Hg)
(C) o potencial da pilha não é afetado pela retirada de qualquer quantidade de carga da célula.
(D) o fluxo de elétrons parte do eletrodo de Hg para o eletrodo de Cd(Hg) pelo circuito externo.
(E) o catodo é formado pelo amálgama de cádmio.
ENADE 2008 - QUESTÃO 28
Certa máquina térmica, que opera segundo o Ciclo de Carnot, recebe 40 kJ de calor da fonte quente. As etapas do ciclo, todas elas reversíveis, estão representadas no gráfico abaixo.
Etapa I → II isotérmica a temperatura T1 = 1.000 K
Etapa II → III adiabática desde 1.000 K até 200 K
Etapa III → IV isotérmica a temperatura T2 = 200 K
Etapa IV → I adiabática desde 200 K até 1.000 K
Qual a variação de entropia, em J/K, na etapa III → IV?
(Dado:n = 1 - (t1/t2), onde n é o rendimento do ciclo, T2 é a temperatura da fonte fria e T1 é a temperatura da fonte quente.)
(A) 40
(B) 20
(C) 0
(D) - 20
(E) - 40
ENADE 2008 - QUESTÃO 29
A figura abaixo representa o diagrama de fases do sistema água, nitrato de chumbo e nitrato de sódio, a 25 °C e 1 atm.
Analisando o diagrama, conclui-se que
(A) o sistema representado pelo ponto O é uma solução saturada em Pb(NO3)2 .
(B) o ponto P representa uma solução duplamente saturada em Pb(NO3)2 e NaNO3.
(C) o ponto S representa o hidrato formado entre o NaNO3 e a água.
(D) o Pb(NO3)2 é mais solúvel em água do que o NaNO3.
(E) a adição de Pb(NO3)2 a soluções aquosas de NaNO3 aumenta a solubilidade do NaNO3 em água.
ENADE 2008 - QUESTÃO 30
Derivados halogenados são bons substratos para a preparação de éteres, em laboratório, através de reação com reagentes nucleofílicos fortes como o metóxido de sódio. A velocidade dessas reações pode ser drasticamente aumentada pela escolha apropriada do solvente.
Considere os substratos 3-bromo-3-metil-hexano e brometo de metila. Qual o tipo de mecanismo e o solvente adequado para a reação desses substratos halogenados com o metóxido de sódio?
(Dado: DMSO corresponde a (CH3)2S=O)

ENADE 2008 - QUESTÃO 31
Recentemente, a imprensa internacional divulgou informação relacionada à contaminação de leite em pó com melamina, cuja estrutura está representada abaixo.
A adulteração do leite tinha como objetivo simular níveis de proteínas mais altos do que os que realmente existiam no leite. As proteínas mais abundantes do leite são as caseínas
(fosfoproteínas de massa molecular da ordem de 18 a 25 kDa).
Comparando a estrutura da melamina com a da caseína, conclui-se que ambas
(A) possuem ligações peptídicas.
(B) geram aminoácidos por hidrólise.
(C) formam polímeros de condensação com o formaldeído.
(D) apresentam o mesmo teor de nitrogênio.
(E) podem ser analisadas por cromatografia gasosa.
ENADE 2008 - QUESTÃO 32
O arsenieto de gálio é um material semicondutor usado na fabricação de diodos emissores de luz, dispositivos que transformam energia elétrica em radiação eletromagnética. O arsenieto de gálio pode ser dopado com outros elementos, gerando semicondutividade do tipo n (formação de nível doador de elétrons) e/ou semicondutividade do tipo p (formação de nível receptor de elétrons). O semicondutor tem uma célula unitária do tipo apresentado na figura abaixo.
Analisando a estrutura cristalina do arsenieto de gálio e sabendo-se que o sítio de As foi dopado por Se, a fórmula do arsenieto de gálio e o tipo de semicondutor formado após a dopagem são, respectivamente,

ENADE 2008 - QUESTÃO 33
A produção de madeira plástica ou compósito de plásticomadeira pode ser feita a partir de resíduos plásticos reciclados. Já pode ser encontrado no mercado nacional um produto resultante da mistura de polietileno de alta densidade (PEAD) com serragem de madeira, pigmentos e plastificante.
A respeito da análise espectroscópica da madeira plástica e de suas matérias-primas, foram feitas as seguintes afirmativas:
I - o espectro de infravermelho do PEAD apresenta bandas de estiramento na região de 1.700 cm-¹ ;
II - o espectro de RMN de ¹³C em solução do PEAD apresenta sinais na região de 120-145 ppm;
III - o espectro de infravermelho da madeira plástica pode ser obtido sob a forma de filme, solubilizando a amostra em um solvente apolar;
IV - o espectro de infravermelho da madeira plástica apresenta bandas na região de 3.400 cm-¹ , provenientes da celulose, e banda na região de 1.450 cm-¹ , proveniente do polietileno.
Está(ão) correta(s) APENAS a(s) afirmativa(s)
(Observação: as tabelas com as faixas características de absorção no infravermelho e deslocamento químico de ¹³C encontram-se ao final deste caderno.)
(A) I
(B) IV
(C) I e III
(D) II e III
(E) II e IV
COMPONENTE ESPECÍFICO / CONTEÚDOS ESPECÍFICOS / BACHAREL
ENADE 2008 - QUESTÃO 34
Os resultados de análises de amostras de 100 mL de água, recolhidas, ao longo de três meses, de um córrego urbano, evidenciaram a presença de, em média, 3,2 mg de matéria orgânica (na forma de glicose – C6 H12O6 – cuja massa molar é 180 g/mol). Autoridades e membros da comunidade local se reuniram para discutir a respeito da qualidade da água do rio. Cinco participantes da reunião emitiram os seguintes pareceres:
P1: A qualidade da água do rio é boa. Há oxigênio na água suficiente para degradar toda a matéria orgânica e manter a vida aquática.
P2: A qualidade da água do rio ainda é boa, uma vez que cerca de três quartos da matéria orgânica podem ser decompostos.
P3: Nas condições atuais, no máximo, 50% da matéria orgânica podem ser decompostos, e a manutenção da vida aquática fica comprometida.
P4: A qualidade da água tornou-se inadequada para sustentar a vida aquática e, nas atuais condições, apenas cerca de 25% da matéria orgânica podem ser decompostos.
P5: A quantidade de matéria orgânica precisa ser reduzida a, aproximadamente, 2% dos níveis atuais para poder sustentar a vida aquática.
Um Químico foi chamado a opinar sobre a veracidade dos pareceres. Para tal, levou em consideração que:
• a concentração mínima de O2 na água para sustentar a vida aquática é de 5 ppm, à temperatura média de 20 °C;
• a solubilidade do oxigênio em rios depende de vários fatores, mas para cálculos mais simples pode ser considerada igual à solubilidade do O2 em água, que é de 9 ppm, a 20 °C e 1atm.
Analisando os dados, o Químico recomendou o Parecer
(A) P1
(B) P2
(C) P3
(D) P4
(E) P5
ENADE 2008 - QUESTÃO 35
A bioquímica experimentou um grande avanço no século XX, graças ao desenvolvimento de métodos de análise como a eletroforese, a ultracentrifugação e a espectrometria de massas, que permitiram separar, purificar e caracterizar biomoléculas.
A respeito desses métodos, são feitas as seguintes afirmações:
I - a desvantagem da eletroforese em gel, em relação à ultracentrifugação, consiste na necessidade de inativar as biomoléculas;
II - na análise de espectrometria de massas por eletrospray, é necessário que as biomoléculas sejam dissolvidas em solventes de baixa volatilidade;
III - a técnica de ultracentrifugação permite separar uma mistura de biomoléculas a partir das suas diferenças de massas;
IV - a eletroforese em gel permite separar biomoléculas neutras em função da habilidade diferenciada das mesmas em se difundirem através do gel sob a ação de um campo elétrico.
Está(ão) correta(s) APENAS a(s) afirmativa(s)
(A) I
(B) II
(C) I e III
(D) I e IV
(E) II e IV
ENADE 2008 - QUESTÃO 36
Considere as curvas da análise termogravimétrica (TGA) obtidas para quatro polímeros: polietileno (PE), polipropileno (PP), politetrafluoretileno (PTFE) e policloreto de vinila (PVC), apresentadas na figura abaixo.
Com base na análise do gráfico, foram feitas as seguintes afirmativas:
I - o PTFE é termorrígido, pois apresenta a maior temperatura de decomposição;
II - o PTFE se decompõe em temperatura maior que o PE, pois a energia da ligação C-F é maior que a energia da ligação C-H;
III - a cadeia ramificada do PP contribui para maior temperatura de decomposição em relação à temperatura de decomposição do PE;
IV - o patamar observado na curva do PVC deve-se à liberação de HCl, sendo este fato uma preocupação no seu processo de reciclagem.
Estão corretas APENAS as afirmativas
(A) I e II
(B) I e IV
(C) II e III
(D) II e IV
(E) III e IV
ENADE 2008 - QUESTÃO 37
Os tensoativos possuem uma porção hidrofílica e outra lipofílica e, quando dissolvidos em concentrações superiores à concentração micelar crítica, formam micelas, que podem ser normais ou reversas, conforme a representação abaixo.
Quanto às propriedades das micelas formadas pelo hexadecanoato de sódio em água, é correto afirmar que sua
(A) estrutura, com uma cabeça polar e uma cauda apolar, é característica da micela reversa.
(B) formação leva ao aumento da tensão superficial na interface ar-água.
(C) formação é termodinamicamente desfavorável por serem as micelas agregados de moléculas com contribuição entrópica positiva.
(D) superfície encontra-se carregada positivamente e, por isso, as micelas permanecem dispersas na fase aquosa.
(E) estabilidade é governada por Forças de Van der Waals e pelas forças entre as duplas camadas elétricas das partículas, segundo a teoria DLVO.
QUESTÃO 38 - RESOLUÇÃO NÃO ENCONTRADA
QUESTÃO 39 - RESOLUÇÃO NÃO ENCONTRADA
QUESTÃO 40 - RESOLUÇÃO NÃO ENCONTRADA
COMPONENTE ESPECÍFICO / CONTEÚDOS ESPECÍFICOS / QUÍMICO COM ATRIBUIÇÕES TECNOLÓGICAS
ENADE 2008 - QUESTÃO 41
Transferência de calor é um fenômeno importante em diversos processos industriais. Considere as seguintes afirmações relativas a um processo em que uma mistura de ar e vapor de água é aquecida, passando através de um trocador de calor duplo tubular que opera na configuração em contra-corrente.
I - A umidade absoluta permanece constante, enquanto a umidade relativa e a temperatura de bulbo úmido diminuem durante o processo.
II - O valor do coeficiente global de troca térmica associado a este processo cresce com o aumento da velocidade do fluido.
III - A taxa de calor trocado depende da viscosidade e da massa específica dos fluidos envolvidos no processo.
IV - As trocas térmicas serão intensificadas pela introdução de irregularidades na superfície do sólido, pois estas intensificam a turbulência do escoamento.
V - Nesse processo existe apenas transferência de calor por condução.
Para o processo apresentado estão corretas APENAS as afirmativas
(A) I, II e III
(B) I, II e IV
(C) I, IV e V
(D) II, III e IV
(E) III, IV e V
ENADE 2008 - QUESTÃO 42
O oxigênio é o receptor final de elétrons na respiração celular. Muitos sistemas enzimáticos de células requerem, para funcionar, um meio extremamente redutor, isto é, um baixo potencial de redução. Outros requerem condições oxidantes, isto é, um potencial de redução elevado. Na figura estão representados, de modo esquemático, os microorganismos quanto à sua demanda de oxigênio. Todos os tubos de ensaio estão abertos para a atmosfera e os microorganismos estão representados pelos pontos pretos.
Considere os processos biotecnológicos a seguir.
Processo X – produção de acetona a partir do Clostridium acetobutylicum (anaeróbio).
Processo Y – produção de tetraciclina a partir de Streptomyces aureofaciens (aeróbio).
Processo Z – produção de dextrana a partir de Leuconostoc mesenteroides (anaeróbio facultativo).
A partir da análise da figura, os tubos de ensaio que representam o comportamento dos microorganismos adequados para os processos X, Y e Z são, respectivamente,
(A) P, R e S
(B) P, R e T
(C) Q, P e R
(D) Q, R e T
(E) T, P e R
ENADE 2008 - QUESTÃO 43
A instalação de uma planta química requer uma análise de riscos cuidadosa. As instalações são classificadas de acordo com o índice de risco. O conhecimento de conceitos relacionados à análise de riscos é importante para que a avaliação seja realizada adequadamente. Dentro deste contexto, como se define risco social?
(A) Probabilidade de que um equipamento ou sistema opere com sucesso por um período de tempo especificado e sob condições de operação definidas.
(B) Número de mortes esperadas por ano em decorrência de acidentes com origem na instalação/atividade, usualmente expresso em mortes/ano.
(C) Todo acontecimento não desejado que pode vir a resultar em danos físicos, lesões, doença, morte, agressões ao meio ambiente, prejuízos na produção, etc.
(D) Medida dos prejuízos econômicos e/ou danos ao meio ambiente ou mortes/danos de pessoas, tanto em termos de probabilidade como de magnitude.
(E) Freqüência anual esperada de morte devido a acidentes com origem em uma instalação para uma pessoa situada em um determinado ponto nas proximidades da mesma.
QUESTÃO 44 - RESOLUÇÃO NÃO ENCONTRADA
QUESTÃO 45 - RESOLUÇÃO NÃO ENCONTRADA
QUESTÃO 46 - RESOLUÇÃO NÃO ENCONTRADA
QUESTÃO 47 - ANULADA
COMPONENTE ESPECÍFICO / CONTEÚDOS ESPECÍFICOS / LICENCIADO
ENADE 2008 - QUESTÃO 48
Leia as propostas de experimento em laboratório descritas a seguir.
Experimento 1 – Colocam-se em uma bancada de laboratório diversos materiais, tais como pedaços de madeira, pregos, bolas de isopor, papéis, rolhas. A seguir, solicita-se aos alunos que determinem a densidade desses materiais a partir da seguinte informação fornecida pelo professor: d = m/v. O professor acompanha o desenvolvimento do trabalho, dirimindo dúvidas, e, ao término da atividade, discute com os alunos os resultados obtidos para cada um dos materiais.
Experimento 2 – O professor explicita aos seus alunos alguns conceitos relativos à solubilidade de sais, explicando quais são solúveis e quais são insolúveis. A seguir, leva-os para o laboratório e solicita aos alunos que façam o experimento, seguindo o roteiro que lhes foi dado, no qual estão relacionadas as várias soluções que devem ser misturadas. Ao final da aula, os alunos devem indicar quais misturas levam à precipitação de um sal e qual o tipo de sal formado, de acordo com o que foi visto em sala de aula.
Experimento 3 – O professor vê na revista Química Nova na Escola dois experimentos muito interessantes: um que apresenta cromatografia de papel, utilizando tinta de caneta, e outro, por meio de oxidação dos metais, possibilita a gravação de várias figuras sobre telas de pintura permeáveis. Monta os dois experimentos em sala de aula, executa-os para que os alunos possam ver, e pede para que eles anotem, discutam os resultados e respondam ao questionário após a explicação do funcionamento dos experimentos.
De que forma foram explorados os experimentos descritos acima?

ENADE 2008 - QUESTÃO 49
O documento “Orientações Curriculares Nacionais” (BRASIL, MEC, 2006) foi construído a partir de avanços oriundos dos Parâmetros Curriculares Nacionais para o Ensino Médio (PCNEM) e das Orientações Educacionais Complementares aos Parâmetros Curriculares Nacionais (PCN+). A esse respeito, considere as afirmações a seguir.
I - O documento deixa claro que é necessário treinar o estudante em relação ao conteúdo, possibilitando que o mesmo se prepare para diversos exames de seleção, que incluem concursos e vestibulares, como meio de inclusão social do estudante.
II - O documento propõe conhecimentos químicos de base comum, mas permite a inclusão de outros conhecimentos de acordo com a realidade e o projeto pedagógico de cada escola, levando em consideração particularidades culturais, sociais e econômicas de cada região.
III - O documento ressalta que a ciência deve ser apresentada ao aluno como uma construção humana, histórica, com implicações e limitações, e enfatiza a importância da experimentação como promotora de aprendizado capaz de articular os saberes teóricos e práticos.
Em relação ao que se propõe nas Orientações Curriculares Nacionais, estão corretas APENAS as afirmativas
(A) I
(B) II
(C) III
(D) I e II
(E) II e III






















COMENTÁRIOS