Prova ITA 2022 (2ª Fase) com Gabarito 1º DIA MATEMÁTICA ITA 2022 - QUESTÃO 01 Seja x ∈ R. Considere um retângulo R de lados medindo a =...
Prova ITA 2022 (2ª Fase) com Gabarito
1º DIA
MATEMÁTICA
ITA 2022 - QUESTÃO 01
Seja x ∈ R. Considere um retângulo R de lados medindo a = 9x² – 5x⁴ e b = 8x – 8x³. Sabendo que o perímetro de R é 8 determine a e b.
ITA 2022 - QUESTÃO 02
Seja z ∈ C e denote por  a parte imaginária de z. Determine todos os possíveis z ∈ C com
a parte imaginária de z. Determine todos os possíveis z ∈ C com  tais que temos simultaneamente
tais que temos simultaneamente  e
e  .
.
ITA 2022 - QUESTÃO 03
Seja A a matriz com 5 linhas e 10 colunas cujas entradas an,m são dadas por

Determine a soma de todas as entradas de A.
ITA 2022 - QUESTÃO 04
No jogo da velha, dois jogadores competem em um tabuleiro ordenado formado por 3 linhas e 3 colunas. Os jogadores se alternam marcando uma casa ainda não ocupada até que um deles ocupe toda uma linha, coluna ou diagonal, sendo declarado o vencedor. Quantas configurações diferentes do tabuleiro correspondem à vitória do primeiro jogador na sua terceira jogada?
ITA 2022 - QUESTÃO 05
Considere arccos : [–1, 1] → [0, π] e arcsen : [–1,1] → [– π/2, π/2]. Determine todos os valores de arccos(x) dado que x satisfaz arccos(x⁴) + arcsen (x² – 1/4) = π/2.
ITA 2022 - QUESTÃO 06
Seja A = (0, 1). Considere a reta r de equação y = 1 – x/4 e seja s uma reta passando pela origem O e que intersecta r no 1º. quadrante em um ponto P. Determine o ponto Q do 2º quadrante que pertence a r e dista √2 de s sabendo que  e que tan(θ) =
e que tan(θ) = 
ITA 2022 - QUESTÃO 07
Considere T um tronco de pirâmide regular de altura h = 4 + 2√3 com bases hexagonais paralelas. Sabendo que o lado da maior base hexagonal mede 8√3/3 e que o ângulo diedral entre as faces laterais e a base do tronco mede 75°, determine o volume de T.
ITA 2022 - QUESTÃO 08
Seja Q um quadrilátero de vértices A, B, C e D cujos lados satisfazem 
e 
Sabendo que Q é inscrito em uma circunferência de raio r, determine r.
ITA 2022 - QUESTÃO 09
Sejam P1 = (0, 6), P2 = (1, 5) e P3 = (2, 6) e sejam C1, C2 e C3 circunferências centradas em P1, P2 e P3, respectivamente. Sabendo que existe uma reta horizontal que é tangente a C1, C2 e C3 determine C1 ∩ C2 ∩ C3 quando este não for vazio.
ITA 2022 - QUESTÃO 10
Considere um octaedro regular de aresta de comprimento l2. Inscreva nesse octaedro um cubo cujos vértices estão nos baricentros das faces do octaedro. Dentro desse cubo inscreva um novo octaedro regular de aresta de comprimento l2 cujos vértices estão nos centros das faces do cubo. Continue com esse processo obtendo uma sequência l1 para i ∈ N. Determine então o valor da razão l10/l1.
QUÍMICA
ITA 2022 - QUESTÃO 01
Considere a seguinte reação química hipotética:
2X + Y ⇄ 3Z
A velocidade dessa reação é igual à constante de velocidade multiplicada pelas concentrações da espécie X elevada ao quadrado e da espécie Y. A constante de velocidade obedece a equação de Arrhenius:
em que Ea representa a energia de ativação e A representa o fator de frequência. Sabendo-se que a energia de ativação da reação é igual a 24,94 kJ·mol⁻¹ a 300 K, concentrações iniciais de X e Y iguais a 0,2 mol·L⁻¹ e Z igual a zero, determine o valor numérico da:
a) constante de velocidade da reação inversa, considerando o atingimento do equilíbrio quando a concentração de Z é igual a 0,15 mol·L⁻¹.
b) velocidade da reação química, considerando o fator de frequência igual a 25,00 x e10 mol⁻²·L²·s⁻¹.
ITA 2022 - QUESTÃO 02
O método de determinação da quantidade de nitrogênio amoniacal (NHx) em amostras de efluentes baseia-se nas seguintes etapas: (i) alcalinização da amostra, com excesso de base forte para produção de amônia, (ii) a qual é posteriormente destilada e recolhida em uma quantidade conhecida de uma solução padrão de ácido bórico. Após reação da amônia com o ácido, (iii) o borato formado é titulado com uma solução padrão de ácido sulfúrico, formando sulfato de amônio.
Considere que uma amostra de 20,00 mL de efluente com densidade de 1,50 g·cm⁻³ foi alcalinizada com excesso de NaOH e que a titulação do borato consumiu 18,00 mL de uma solução aquosa 0,500 mol·L⁻¹ em ácido sulfúrico.
Com base nessas informações:
a) escreva as reações químicas balanceadas que representam cada uma das etapas envolvidas nesse método.
b) calcule o valor numérico da massa (em g) de sulfato de amônio formado.
c) calcule o valor numérico da massa (em g) de nitrogênio na amostra.
d) calcule o valor numérico do percentual do elemento N na amostra.
ITA 2022 - QUESTÃO 03
Um químico carregou um reator com 20 atm de uma mistura gasosa, constituída de uma substância A e de um componente inerte I, em uma proporção molar de A: I igual a 4:1. A temperatura do reator foi mantida constante e a pressão total foi monitorada, o que permitiu determinar a velocidade da reação em função do tempo, de acordo com os dados da tabela.
Com base nesses dados e sabendo que a estequiometria da reação é 2A(g) → 3B(g), pede-se:
a) O valor numérico da ordem da reação.
b) O valor numérico da constante de velocidade com sua unidade de medida.
c) A composição no interior do reator no tempo 10,42 minutos em termos das pressões parciais (em atm) de cada componente.
d) O valor numérico do tempo de meia vida da reação.
ITA 2022 - QUESTÃO 04
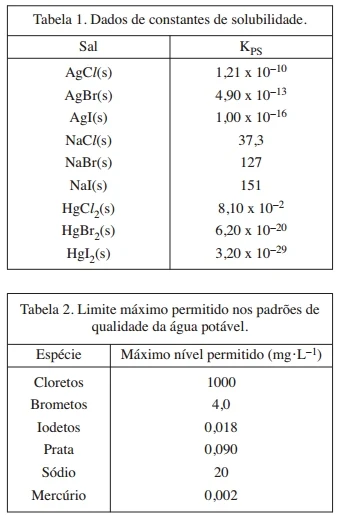
Um novo método para potabilização da água residual em espaçonaves emprega íons de prata como agente bactericida. Considere os dados de produto de solubilidade de alguns sais apresentados na Tabela 1 e o limite máximo permitido de íons nos padrões de qualidade da água potável disposto na Tabela 2.
Sabe-se que concentrações de íons de prata acima de dez partes por bilhão (>10 ppb) são suficientes para prevenir o crescimento de bactérias, algas e outros microor ganismos. A estratégia do método consiste em assegurar uma concentração fixa de Ag+ na água potável por meio da saturação da solução com um sal de prata moderadamente solúvel. Com base nessas informações, responda:
a) Dentre os sais de prata apresentados na Tabela 1, indique qual(is) poderia(m) ser empregado(s) no método de potabilização da água e calcule a concentração em ppb de Ag⁺ na solução resultante.
b) Dentre os sais de prata que não poderiam ser usados no item (a) e considerando o limite máximo permitido nos padrões de qualidade da água potável, indique aquele(s) sal(is) que poderia(m) ser empregado(s), juntamente com NaCl ou HgCl2, para ajustar a concentração total de Ag⁺ para 10,8 ppb. Determine o valor numérico da concentração final de Na⁺ ou Hg²⁺ em cada situação.
ITA 2022 - QUESTÃO 05
Na reação conhecida como “cão que late”, uma mistura de óxido nitroso e dissulfeto de carbono entra em combustão, gerando um clarão azulado e um som parecido com “woof” ou “uulsh”. Considerando uma combustão com pleta e que todo o enxofre gerado se encontra na forma de sólido S8:
a) escreva a equação química balanceada dessa reação.
b) determine o valor numérico do volume de gás gerado (em litros) para cada 304 g de dissulfeto de carbono que reagiu de forma estequiométrica. Considere a pressão igual a 10⁵ Pa e a temperatura de 300 K.
c) calcule o valor numérico da massa de enxofre sólido (em g) gerado considerando a mesma quantidade de dissulfeto de carbono do item (b).
ITA 2022 - QUESTÃO 06
Considere os seguintes pares de homopolímeros, representados pelas respectivas fórmulas estruturais. Para cada par, indique qual homopolímero terá temperatura de fusão maior, considerando que suas massas molares sejam similares. Justifique a sua resposta.

ITA 2022 - QUESTÃO 07
Considere as seguintes informações:
I. Primeira energia de ionização do cálcio: 590 kJ·mol⁻¹
II. Segunda energia de ionização do cálcio: 1145 kJ·mol⁻¹
III. Afinidade eletrônica do cloro: – 340 kJ·mol⁻¹
IV. Entalpia de solubilização do cloreto de cálcio: – 81 kJ·mol⁻¹
V. Entalpia de hidratação do íon de cálcio: – 1579 kJ·mol⁻¹
VI. Entalpia de hidratação do íon de cloro: – 378 kJ·mol⁻
Com base nessas informações, responda os itens abaixo.
a) Represente, na forma de equações químicas, as informações acima (I-VI).
b) Equacione a reação de entalpia de rede do cloreto de cálcio a partir das equações I-VI, conforme a necessidade.
c) Calcule o valor numérico da entalpia de rede do cloreto de cálcio (em kJ·mol⁻¹).
ITA 2022 - QUESTÃO 08
Em um reator químico vazio, mantido a altas tem peraturas, injeta-se uma mistura gasosa, com massa molaraparente igual a 29 g·mol⁻¹, constituída de amônia e oxigênio puros. Os gases reagem entre si formando óxido nítrico e água no estado gasoso. Ao final do processo, toda a amônia é consumida e são formados 20 mol de óxido nítrico. A respeito deste processo, pede-se:
a) A equação química balanceada.
b) Os valores numéricos das frações molares de amônia e de oxigênio no início da reação.
c) O valor numérico da porcentagem de reagente em excesso.
d) Os valores numéricos das quantidades (em mols) das espécies químicas no final da reação.
ITA 2022 - QUESTÃO 09
A etilcarbilamina ou isocianeto de etila é utilizada como reagente em duas rotas reacionais:
(i) Aquecimento a 250 °C que leva a sua isomerização funcional com a formação de um composto A, o qual reage com o cloreto de metil magnésio e, posteriormente, forma uma cetona B por hidrólise;
(ii) Hidrólise em meio ácido com a formação de uma amina primária C e um composto D.
Com base no enunciado, escreva as reações químicas envolvidas nas rotas (i) e (ii). Escreva a estrutura química dos compostos A, B, C e D.
ITA 2022 - QUESTÃO 10
Uma mistura de cloreto de cálcio e fluoreto de sódio, de massa igual a 39,0 g, foi adicionada à água, sendo observada a formação de um precipitado (Precipitado 1), o qual foi removido por filtração. Ao sobrenadante, foram adicionados 900 mL de uma solução aquosa 0,5 mol L⁻¹ em nitrato de prata, sendo essa quantidade em excesso para garantir a formação de um precipitado (Precipitado 2) que também foi removido por filtração.
Posteriormente, foi adicionada a essa nova solução sobrenadante uma placa polida de zinco metálico. Após um tempo suficientemente longo, observou-se um aumento de massa dessa placa igual a 3,76 g. A partir dessas observações:
a) apresente todas as equações que representam as reações químicas balanceadas envolvidas no processo, identificando cada um dos precipitados.
b) calcule o valor numérico do número de mols do Precipitado 2.
c) calcule o valor numérico das massas de cloreto de cálcio e fluoreto de sódio na mistura inicial.


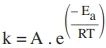







COMENTÁRIOS