Prova Química (Bacharelado e Licenciatura) ENADE 2017 com Gabarito
Prova Química (Bacharelado e Licenciatura) ENADE 2017 com Gabarito
OBS: as questões de 01 a 08 são de Formação Geral, portanto, cobradas em todas as provas. Para conferir elas, basta acessar essa página.
CONHECIMENTO ESPECÍFICO
BACHARELADO
QUESTÃO 09
ENADE 2017: Devido à sua muito baixa reatividade, acreditava-se que os gases nobres eram quimicamente inertes, concepção que deu nome a esses elementos e que perdurou até o ano de 1962, quando o químico inglês N. Bartlett sintetizou o primeiro composto de gás nobre.
Atualmente, sabe-se que o xenônio apresenta energia de ionização suficientemente baixa para formar moléculas com átomos muito eletronegativos, especialmente com o flúor. Alguns desses fluoretos são usados como poderosos agentes oxidantes, conforme se pode observar na fluoração representada a seguir.
Pt(s) + XeF4(g) > Xe(g) → PtF4(s)
ATKINS, P. W; JONES, L. Princípios de Química: questionando a vida
moderna e o meio ambiente. 5. ed, Porto Alegre:
Bookman, 2011 (adaptado).
Com relação às informações apresentadas no texto, avalie as afirmações a seguir.
I. A geometria molecular do composto de gás nobre usado na fluoração da platina é quadrática plana.
II. A hibridação do átomo de xenônio no fluoreto oxidante é sp³d² .
III. A molécula do oxidante usado na fluoração da platina é apolar.
É correto o que se afirma em
A) I, apenas.
B) II, apenas.
C) I e III, apenas.
D) II e III, apenas.
E) I, II e III.
QUESTÃO 10
ENADE 2017: Uma reação importante dos ácidos carboxílicos e de seus derivados é a substituição nucleofílica. Os derivados de ácidos, tais como os cloretos de acila, são muito reativos e, por essa razão, são utilizados na obtenção de derivados de ácido como os ésteres, anidridos e amidas. Considere a síntese do acetato de etila a partir do cloreto de acetila e etanol, realizada na presença de pirídina, que neutraliza o excesso de ácido clorídrico gerado.
O cloreto de acetila apresenta duas estruturas de ressonância, conforme mostrado a seguir.
Considerando essas informações, avalie as afirmações a seguir.
I. Na reação mencionada, o nucleófilo ataca o carbono da carbonila e, em seguida, ocorre a eliminação do grupo abandonador, o que resulta na conversão de um derivado de ácido carboxílico em outro.
II. A reação favorável é a formação do éster, pois, quanto menos básico for o grupo abandonador, mais reativo será o composto formado.
III. No que se refere à formação do híbrido de ressonância do cloreto de acetila, quanto maior for a contribuição da estrutura de ressonância 2, mais reativo será o composto.
IV. O efeito indutivo retirador de elétrons do grupo abandonador aumenta a contribuição da estrutura de ressonância 2, o que explica a maior reatividade do cloreto de ácido em relação ao éster formado.
É correto apenas o que se afirma em
A) I e II.
B) II e III.
C) III e IV.
D) I, II e IV.
E) I, III e IV.
QUESTÃO 11
ENADE 2017: Alguns metais, como o ouro, o cobre e o ferro, são usados desde a antiguidade. O alumínio metálico, no entanto, só começou a ser usado no século XIX, produzido por eletrólise do Al2O3na presença de fundente.
Considerando a necessidade da eletrólise ígnea para a obtenção do alumínio, avalie as afirmações a seguir.
I. A energia necessária para ionizar o composto Al2O3 é alta.
II. O caráter covalente é predominante nas ligações entre Al e O.
III. As cargas dos íons são elevadas, o que aumenta a atração entre os átomos.
É correto o que se afirma em
A) I, apenas.
B) II, apenas.
C) I e III, apenas.
D) II e III, apenas.
E) I, II e III.
QUESTÃO 12
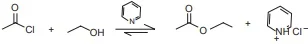
ENADE 2017: Uma professora propôs como desafio a identificação de cinco soluções aquosas desconhecidas, de concentração igual a 2,0 g.L⁻¹. A professora informou os cinco possíveis solutos: CaCl2, CH3COOK, HO2CCO2H, Ba(OH)2 e Na2CO3.
Para fazer a identificação, os alunos receberam um pH-metro, um bico de Bunsen e um fio de Ni-Cr limpo cuja chama era azul. Os valores de pH e cores da chama das cinco soluções foram registrados na tabela a seguir.
Com base nessas informações, concluiu-se que as soluções 1, 2, 3, 4 e 5 contêm, respectivamente, os solutos
A) Ba(OH)2; HO2CCO2H; Na2CO3; CH3COOK; CaCl2.
B) Na2CO3; CH3COOK; Ba(OH)2; CaCl2; HO2CCO2H.
C) Na2CO3; HO3CCO2H; Ba(OH)2; CaCl2; CH3COOK.
D) CH3COOK; HO2CCO2H; Na2CO3; Ba(OH)3; CaCl2.
E) CH3COOK; HO2CCO2H; Ba(OH)2; CaCl2; Na2CO3.
QUESTÃO 13
ENADE 2017: A partir do estudo com espectroscopia UV-Visível, quatro amostras de soluções com diferentes concentrações conhecidas de aspirina foram analisadas, utilizando-se uma cubeta com caminho óptico de 1 cm. A curva analítica com os valores de absorbância (eixo y) por concentração de aspirina (eixo x) forneceu uma reta com os seguintes parâmetros: coeficiente linear = 10x10⁻⁴ e coeficiente angular = 7,6x10² mor⁻¹.L.
Considerando que o sistema estudado atende aos pressupostos da Lei de Lambert-Beer, avalie as afirmações a seguir.
I. O coeficiente de absortividade molar (£), nas condições experimentais descritas, é 1,0x10⁻⁴mol.L.cm⁻¹.
II. Amostra de uma solução que contenha aspirina com absorbância de 0,2 apresentará concentração de 2,6 x 10⁻⁴ mol.L⁻¹.
III. As concentrações de aspirina puderam ser determinadas devido à absorção se dar na região do visível.
IV. A variação da absorbância em função da concentração do analito tem relação direta com o coeficiente de absortividade da aspirina e com o comprimento do caminho óptico da cubeta.
É correto apenas o que se afirma em
A) I e III.
B) II e IV.
C) III e IV.
D) I, II e III.
E) I, II e IV.
QUESTÃO 14
ENADE 2017: A urina tem dois compostos, amônia e ureia, que podem ser usados como fonte de hidrogênio. Ao se colocar um eletrodo no líquido e aplicar-se uma corrente elétrica de baixa intensidade, o gás hidrogênio produzido pode ser usado para alimentar uma célula a combustível. A tecnologia proposta utiliza um sistema que opera de forma muito parecida com a eletrólise da água, com a vantagem de a energia necessária para romper a ligação N-H ser menor que aquela necessária para romper a ligação O-H.
Disponível em: <http://www.bbc.com>. Acesso em: 12 jul. 2017 (adaptado).
A respeito dos processos eletroquímicos descritos no texto, avalie as afirmações a seguir.
I. A eletrólise é um processo termodinamicamente desfavorável.
II. A eletrólise envolve conversão de energia química em energia elétrica por meio de reações eletroquímicas.
III. As semirreações com maior potencial-padrão de redução ocorrem preferencialmente nos processos eletrolíticos.
IV. O processo de produção de gás hidrogênio a partir da urina é menos vantajoso energeticamente em comparação ao processo que utiliza água.
É correto apenas o que se afirma em
A) I e III.
B) II e IV.
C) III e IV.
D) I, II e III.
E) I, II e IV.
QUESTÃO 15
ENADE 2017: A reforma a vapor do metano é uma reação química endotérmica entre metano e água, conduzida a cerca de 20 atm e 800 ºC, na presença de níquel metálico, a partir da qual se produz uma mistura de gás hidrogênio e monóxido de carbono, que é muito utilizada em processos químicos industriais.
Sobre essa reação, avalie as afirmações a seguir.
I. Elevar a pressão do sistema reacional deslocaria o equilíbrio químico no sentido de formar mais gás hidrogênio e monóxido de carbono.
II. A utilização de temperaturas elevadas é favorável dos pontos de vista cinético e termodinâmico.
III. Aumentar a fração molar de vapor de água na entrada do reator eleva a quantidade produzida de gás hidrogênio.
IV. Empregar níquel metálico sob a forma de partículas finamente divididas aumenta o rendimento da reação.
É correto apenas o que se afirma em
A) I e III.
B) II e III.
C) II e IV.
D) I, II e IV.
E) I, III e IV.
QUESTÃO 16
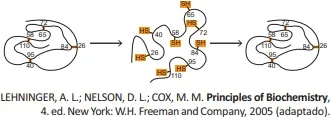
ENADE 2017: A figura a seguir representa o processo de desnaturação da proteína ribonuclease por exposição a uma solução concentrada de ureia na presença de um agente redutor, seguida do processo de renaturação.
Sobre o processo descrito, assinale a opção correta.
A) A desnaturação apresentada ocorre pela ruptura das ligações peptídicas da proteína.
B) A atividade catalítica da proteina renaturada é exatamente a mesma da proteína original.
C) Um agente oxidante, como o permanganato de potássio, é capaz de reverter a redução e restaurar a atividade catalítica da ribonuclease.
D) A estrutura terciária da proteína apresentada é mantida por ligações de hidrogênio entre grupos de diferentes polaridades, como aminoácidos com átomos de nitrogênio protonados e hidrogênios ácidos de outros aminoácidos.
E) O aumento do pH do meio em que a ribonuclease estiver presente causará a protonação dos resíduos correspondentes de alguns aminoácidos e provocará a desnaturação enzimática, que pode ser revertida por meio da restauração do pH original.
QUESTÃO 17
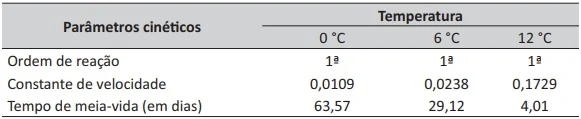
ENADE 2017: A manga Palmer (Mangifera indica L.) destaca-se como fruta de alto valor comercial em muitas regiões do mundo, por apresentar ótima qualidade sensorial e ser rica em vitaminas A e C. Um estudo foi realizado com o objetivo de utilizar parâmetros cinéticos para avaliar a degradação de vitamina C de mangas armazenadas a 0 ºC, 6 ºC e 12 ºC, por 10 dias, conforme mostrado na tabela a seguir.
AIVES, 1. A. et al. Cinética de degradação de vitamina C em mangas “Palmer” minimamente processadas armazenadas
em diferentes temperaturas. Ciênc. agrotec., Lavras, v. 34, n. 3, p. 719, maio/jun., 2010 (adaptado).
Com relação aos resultados apresentados, avalie as afirmações a seguir.
I. Para uma reação que possui cinética de 1º ordem, o tempo necessário para ser consumido todo o reagente corresponde ao dobro do tempo de meia-vida.
II. Os parâmetros cinéticos obtidos indicam que o teor de vitamina C das mangas Palmer minimamente processadas decresce quando elas são armazenadas em temperaturas mais altas.
III. Durante o período do estudo, a perda de vitamina C em todas as amostras foi inferior a 50% do valor inicial, o que demonstra que o teor de vitamina C é parâmetro adequado para acompanhar 2 vida útil de mangas minimamente processadas.
É correto o que se afirma em
A) II, apenas.
B) III, apenas.
C) I e II, apenas.
D) I e III, apenas.
E) I, II e III.
QUESTÃO 18
ENADE 2017: Uma equação representativa do processo de formação do O3 e 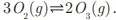 A altas altitudes, a radiação ultravioleta (UV) é intensa, porém a concentração de O2 é baixa para produzir muito oxigênio atômico. A baixas altitudes, a concentração de O2 é alta, porém a radiação UV é reduzida. A uma altitude intermediária, a produção de O3 é máxima. A presença de compostos clorados na atmosfera dá origem ao cloro atômico, que catalisa a decomposição do ozônio por meio das seguintes reações:
A altas altitudes, a radiação ultravioleta (UV) é intensa, porém a concentração de O2 é baixa para produzir muito oxigênio atômico. A baixas altitudes, a concentração de O2 é alta, porém a radiação UV é reduzida. A uma altitude intermediária, a produção de O3 é máxima. A presença de compostos clorados na atmosfera dá origem ao cloro atômico, que catalisa a decomposição do ozônio por meio das seguintes reações:  e
e 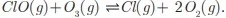 .
.
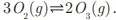 A altas altitudes, a radiação ultravioleta (UV) é intensa, porém a concentração de O2 é baixa para produzir muito oxigênio atômico. A baixas altitudes, a concentração de O2 é alta, porém a radiação UV é reduzida. A uma altitude intermediária, a produção de O3 é máxima. A presença de compostos clorados na atmosfera dá origem ao cloro atômico, que catalisa a decomposição do ozônio por meio das seguintes reações:
A altas altitudes, a radiação ultravioleta (UV) é intensa, porém a concentração de O2 é baixa para produzir muito oxigênio atômico. A baixas altitudes, a concentração de O2 é alta, porém a radiação UV é reduzida. A uma altitude intermediária, a produção de O3 é máxima. A presença de compostos clorados na atmosfera dá origem ao cloro atômico, que catalisa a decomposição do ozônio por meio das seguintes reações:  e
e 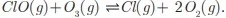 .
.Sobre processos de formação e decomposição do ozônio, avalie as afirmações a seguir.
I. O cloro atômico altera a variação de entalpia do sistema 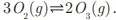 .
.
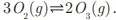 .
.II. A variação de entalpia-padrão de formação do ozônio é diferente de zero.
III. A decomposição do ozônio é acompanhada de decréscimo da entropia do sistema.
É correto o que se afirma em
A) I, apenas.
B) II, apenas.
C) I e III, apenas.
D) II e III, apenas.
E) I, II e III.
QUESTÃO 19
ENADE 2017: Química Verde pode ser definida como o desenho, - o desenvolvimento e a implementação de produtos químicos e processos para reduzir ou eliminar o uso - ou geração de substâncias nocivas à saúde humana e ao ambiente.
LENARDÃO, E. J. et al. Green Chemistry: os 12 princípios da Química
Verde e sua inserção nas atividades de ensino e pesquisa.
Quím. Nova, vol. 26, n. 1, 123-129, 2003 (adaptado).
Considerando os princípios da Química Verde, avalie os conceitos apresentados a seguir.
I. Concepção de processos para maximizar a conversão de matéria-prima em produto.
II. Prioridade da utilização de matérias-primas e fontes de energia abundantes em relação às renováveis.
III. Realização de reações em solução com a máxima diluição possível, com vistas à redução de riscos associados a altas concentrações de solutos.
IV. Concepção de processos de eficiência energética.
É correto apenas o que se afirma em
A) I e IV.
B) II e III.
C) II e IV.
D) I, II e III.
E) I, III e IV.
QUESTÃO 20
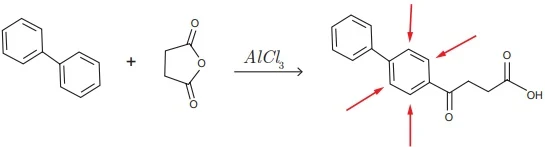
ENADE 2017: Das reações de substituição em compostos aromáticos, as reações de alquilação e acilação de Friedel- Crafts são conhecidos exemplos de formação de ligação carbono-carbono, sendo particularmente útil quando se substitui um ou mais hidrogênios do anel aromático por grupos alquila e acila, respectivamente.
Na reação de acilação de Friedel-Crafts, o benzeno, quando tratado com cloreto de ácido e na presença de cloreto de alumínio, promove a formação de cetonas aromáticas. Essa reação também pode ser realizada na presença de anidridos e cloreto de alumínio, e é empregada na síntese do fenbufeno, conforme representado a seguir.
Considerando o texto e o esquema apresentados, avalie as afirmações a seguir.
I. Na formação do fenbufeno, a substituição dos hidrogênios do anel aromático ocorre preferencialmente na posição para em relação à posição orto, uma vez que o reagente é muito volumoso.
II. Na acilação de Friedel-Crafts, como mostrado no esquema, o cloreto de alumínio atuacomo ácido de Lewis, necessário para tornar o carbono reagente carbonilado (anidrido) mais nucleofílico.
III. No espectro de ressonância magnética de prótons do fenbufeno, todos os quatro hidrogênios no anel aromático, presentes na região da figura indicada por setas, são equivalentes, registrados como duplos dubletes e apresentam deslocamentos em uma mesma região do espectro.
IV. No espectro de infravermelho do fenbufeno, a presença de um sinal largo e forte - característico de deformação axial do grupo OH com frequência em torno de 3 300 cm⁻¹ e de um sinal agudo na região de 1750 - 1800 cm⁻¹ - característico da deformação axial da ligação C=O - são usadas para a identificação de um grupo funcional do produto.
É correto apenas o que se afirma em
A) I e II.
B) I e IV.
C) III e IV.
D) I, II e III.
E) II, III e IV.
QUESTÃO 21
ENADE 2017: Um vazamento de amônia, gás utilizado para a refrigeração, provocou a intoxicação de funcionários de um frigorífico. Segundo o gerente da empresa, o vazamento “foi resolvido de imediato, mas a amônia levou alguns minutos para se dissipar. Por segurança, evacuamos toda a área e dispensamos os funcionários”.
Ocorrências como essa, associadas à utilização, em grande escala, da amônia em empresas de alimentação, têm gerado grande preocupação nas áreas de saúde, segurança e meio ambiente. Planos de emergência devem ser estabelecidos, incluindo formas de redução das concentrações de amônia em caso de vazamentos.
Em situações como a mencionada no texto, a medida mais eficiente para se minimizar a rápida dispersão e controlar o vazamento de amônia em ambientes industriais é
A) abrir todas as portas e janelas, para que o gás se disperse no ambiente.
B) diminuir a temperatura do ambiente, para que "s gases se dispersem mais lentamente.
C) aspergir água, para forçar a reação de hidratação e formação do hidróxido de amônio.
D) aspergir uma solução ácida, para forçar a reação de neutralização e formação de um sal.
E) passar o gás através de filtros, para forçar a reação com substâncias que retenham a amônia.
QUESTÃO 22
ENADE 2017: O modelo cinético usual para a catálise enzimática resulta na equação de Michaelis-Menten, apresentada a seguir.
em que V é a velocidade da reação, Vm é a velocidade máxima da reação enzimática, [S] é a concentração de substrato e KM é a constante de Michaelis-Menten, que representa a concentração de substrato capaz de fazer com que a reação ocorra com a metade de sua velocidade máxima. No fígado, o etanol é convertido em acetaldeído pela enzima álcool desidrogenase.
O acetaldeido é o responsável pelos sintomas de ingestão de etanol (rubor facial, taquicardia etc.). Normalmente, o acetaldeído é processado no ser humano pela enzima acetaldeído desidrogenase, que o converte em acetato. A maioria das pessoas apresenta duas formas de acetaldeído desidrogenase, a mitocondrial (baixo KM ) e a citosólica (alto KM ). Em algumas pessoas, no entanto, a enzima mitocondrial é menos ativa, sendo, por isso, o acetaldeído processado apenas pela enzima citosólica.
Com base nessas informações, conclui-se que esse grupo menor de pessoas, comparativamente à maioria das pessoas, apresenta
A) igual intensidade dos sintomas decorrentes da ingestão do etanol, uma vez que este é metabolizado na forma de acetaldeído.
B) maior intensidade dos sintomas decorrentes da ingestão do etanol, uma vez que o acetaldeído resultante é processado majoritariamente por uma enzima mais ativa.
C) menor intensidade dos sintomas decorrentes da ingestão do etanol, uma vez que o acetaldeído resultante é processado majoritariamente por uma enzima mais ativa.
D) maior intensidade dos sintomas decorrentes da ingestão do etanol, uma vez que o acetaldeído resultante é processado majoritariamente por uma enzima menos ativa.
E) menor intensidade dos sintomas decorrentes da ingestão do etanol, uma vez que o acetaldeído resultante é processado majoritariamente por uma enzima menos ativa.
QUESTÃO 23
ENADE 2017: Eletrodos opticamente transparentes são constituídos de um substrato, como o vidro, recoberto de um filme fino de óxido, como o SnO2, que pode ser dopado ou não com outros elementos.
Pode-se sintetizar o SnO2, a partir da seguinte reação: SnCl4 +2H2O → SnO2 + 4HCl, conduzida a 600ºC.
Esses materiais são usados, por exemplo, em portas de geladeiras de supermercados, com passagem de corrente elétrica após sua abertura, evitando-se que fiquem embaçadas.
CARDOSO, W.S. et al. Preparação de eletrodos opticamente ativos.
Química Nova. 28(2), 1, 2005 (adaptado).
Considerando essas informações, verifica-se que uma maneira de aumentar a condutividade elétrica dos eletrodos opticamente transparentes é
A) substituir o SnO2 pelo SnCl4.
B) adicionar um elemento do grupo dos metais alcalinos, formando um sal complexo.
C) aumentar a solubilidade do SnO2 depois da aplicação do filme, pela adição de solventes orgânicos.
D) mudar a geometria do composto, de tetraédrica para quadrado plana, pela adição de elementos de transição.
E) dopar o óxido com um elemento que tenha elétrons disponíveis, diminuindo a separação entre as bandas de valência e de condução.
QUESTÃO 24
ENADE 2017: O but-1-eno pode ser obtido por meio da dimerização do eteno. Ambos os compostos são gasosos à temperatura ambiente. A dimerização do eteno produz, conforme as condições experimentais, diferentes proporções de but-l-eno, but-2-eno (cis e trans) e produtos adicionais de oligomerização.
Nesse contexto, é mais conveniente medir-se a eficiência de um sistema catalítico para a dimerização do eteno usando-se a técnica de
A) espectroscopia Raman.
B) cromatografia líquida de alta eficiência.
C) ressonância magnética nuclear de carbono.
D) espectroscopia no infravermelho por refletância difusa.
E) cromatografia gasosa acoplada à espectrometria de massas.
QUESTÃO 25
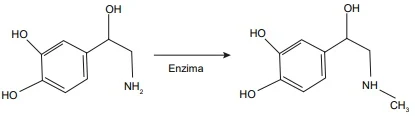
ENADE 2017: A adrenalina é produzida na glândula adrenal e regula o metabolismo energético nos músculos, fígado e tecido adiposo, além de servir como neurotransmissor. A reação de biossíntese dessa molécula ocorre em cinco etapas. O último passo está representado na figura a seguir, em que a R noradrenalina se transforma na R-adrenalina pela ação de uma enzima.
Disponível em: <http://www2.ccc.uni-erlangen.de>. Acesso em: 15 jul. 2017 (adaptado).
Sobre a reação apresentada na figura, avalie as afirmações a seguir.
I. Areação representada é de substituição eletrofílica.
II. Para mimetizar-se a reação representada, pode-se usar CH3I.
III. A adrenalina formada pode ser detectada por meio de espectroscopia na região do infravermelho.
É correto o que se afirma em
A) I, apenas.
B) II, apenas.
C) I e III, apenas.
D) II e III, apenas.
E) I, II e III.
QUESTÃO 26
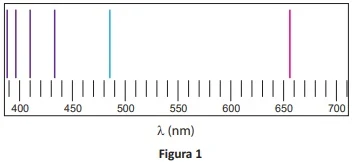
ENADE 2017: A figura 1 mostra o espectro de emissão do hidrogênio atômico na região do visível. Nela, pode-se identificar uma série de linhas discretas de emissão de radiação eletromagnética. Quando espectros de alta resolução do hidrogênio atômico são examinados, observa-se que a linha vermelha aparece dividida em linhas bem pouco espaçadas, como mostrado na figura 2.
Disponivel em:<https://www.itp.uni-hannover.de>
Acesso em: 16 jul. 2017 (adaptado).
Disponível em: <http://yperphysics.phy-astr.gsu.edu>.
Acesso em: 16 jul. 2017 (adaptado).
Com relação a esse contexto, avalie as asserções a seguir e a relação proposta entre elas.
I. O modelo atômico de órbitas estacionárias com energias quantizadas proposto por N. Bohr é capaz de explicar o espaçamento entre as linhas do espectro representado na figura 1, mas não é capaz de explicar as linhas separadas, representadas na figura 2.
PORQUE
II. A separação da linha vermelha, mostrada na figura 2, deve-se à interação entre o momento angular orbital e o momento angular de spin do elétron, cuja derivação surge da extensão relativística da mecânica quântica desenvolvida por P. Dirac.
A respeito dessas asserções, assinale a opção correta.
A) As asserções I e II são proposições verdadeiras, e a II é uma justificativa correta da I.
B) As asserções I e II são proposições verdadeiras, mas a II não é uma justificativa correta da I.
C) A asserção I é uma proposição verdadeira, e a II é uma proposição falsa.
D) A asserção I é uma proposição falsa, e a II é uma proposição verdadeira.
E) As asserções I e II são proposições falsas.
QUESTÃO 27
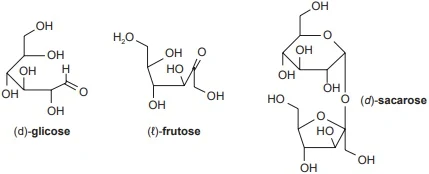
ENADE 2017: Uma amostra de mel foi tratada de forma que seus carboidratos fossem separados dos demais constituintes, como proteínas e sais minerais. Em seguida, a fração de carboidratos foi submetida à cromatografia líquida de alta eficiência (CLAE), modo preparativo, para serem isolados todos os seus constituintes. Como resultado, três carboidratos (Am1, Am2 e Am3) foram separados e purificados.
Sabendo que o me! contém glicose, frutose e sacarose como carboidratos, cujas estruturas moleculares estão representadas na figura, foram empregadas espectrometria de massas (EM) e polarimetria, para se descobrir a identidade de Am1, Am2 e Am3. Os resultados estão apresentados na tabela.
NELSON, D. L.; COX, M. M. Princípios de Bioquímica de Lehninger. 6. ed. Porto Alegre: Artmed, 2014 (adaptado).
Com relação às características dos carboidratos e aos processos de separação e caracterização, avalie as afirmações a seguir.
I. O composto Am3 é a glicose.
II. Os dados de EM apresentados na tabela permitem diferenciar a aldose da cetose.
III. A CLAE com coluna de exclusão molecular não separaria Am1 de Am3.
IV. Os métodos de caracterização usados são destrutivos para as amostras.
V. O valor medido no polarímetro corresponde ao ângulo de refração das ondas eletromagnéticas após passarem por dois meios: solução da amostra e ar.
É correto apenas o que se afirma em
A) I e III.
B) I e IV.
C) II e III.
D) II e IV.
E) IV e V.
QUESTÃO 28
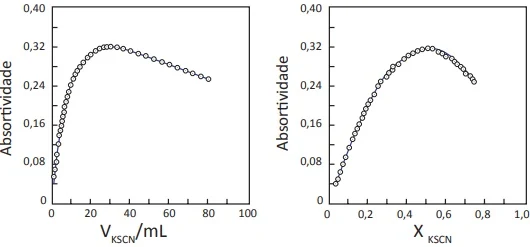
ENADE 2017: Uma forma experimental de se determinar estequiometria é pelo Método de Job, também conhecido como método das variações contínuas. Conforme esse método, monitora-se a variação de alguma propriedade em função da fração molar de um dos reagentes.
É um método bastante empregado na determinação da composição química de complexos de metais de transição que são, em sua maioria, coloridos, monitorando-se a absortividade das soluções em um comprimento de onda referente ao máximo de absorção desses complexos.
Em experimento para determinar-se a composição química do complexo formado por Fe³⁺ e o ligante tiocianato, SCN⁻, foi feita a titulação espectrofotométrica de 30mL de solução aquosa do nitrato desse íon metálico com uma solução de tiocianato de potássio, ambas a 1,0 x 10⁻³mol.L⁻¹.
As figuras a seguir mostram a absortividade molar da solução a 455 nm em função do volume de tiocianato de potássio adicionado e em função da fração molar de ligante.
HIUL, Z. D.; MACCARTY, P. A Novel Approach to Job's Method: An Undergraduate Experiment.
Journal of Chemical Education, 63(2), p.162-167, 1986 (adaptado).
Com base nos resultados do experimento, assinale a alternativa que corresponde ao complexo formado entre os compostos mencionados.
A) K3[Fe(SCN)6]
B) [Fe(H2O)(SCN)3]
C) K2[Fe(H2O)(SCN)5]
D) [Fe(H2O)4(SCN)2]NO3
E) [Fe(H2O)5(SCN)](NO3)2
QUESTÃO 29
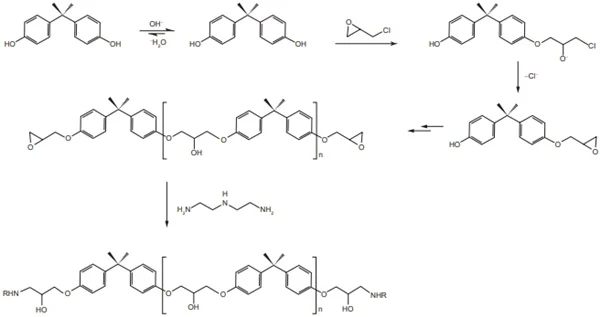
ENADE 2017: Adesivos à base de resinas epóxi são polímeros extremamente fortes que aderem a diferentes superfícies. Usualmente, o polímero é formado a partir do conteúdo de dois tubos, um contendo o chamado pré-polímero e outro, uma triamina.
O pré-polímero é formado a partir da reação do bisfenol “A” com a epicloridrina, que reagem com uma triamina, formando a resina epóxi, como mostrado na figura a seguir.
Considerando as informações apresentadas, é correto afirmar que o papel da triamina na formação da resina epóxi é
A) desprotonar o bisfenol “A”, gerando o respectivo fenóxido.
B) aumentar a cadeia linear do pré-polímero, tornando-o sólido.
C) uniras diferentes cadeias do pré-polímero, por meio de ligações cruzadas.
D) evitar a racemização do fragmento em ponte no bisfenol, que conduziria a um polímero atático.
E) favorecer a saída de cloreto na terceira etapa, por meio da formação de um sal quaternário de amônio.
ENADE 2017 - QUESTÃO 30 - ANULADA
QUESTÃO 31
ENADE 2017: A demanda por Acreditação de Laboratórios de Ensaios e Calibração tem sido crescente nos últimos anos. Em decorrência disso, conhecimentos nessa área vêm sendo solicitados aos químicos em processos seletivos.
Com relação a essas práticas, avalie as afirmações a seguir.
I. A demanda por laboratórios acreditados está aumentando em decorrência da globalização, do aumento da concorrência no mercado e da busca por calibrações e resultados de ensaios mais confiáveis e tecnicamente válidos.
II. A confiabilidade técnica de um laboratório pode ser atestada por meio da certificação ISO 9001 e da validação dos métodos de calibração e/ou ensaio utilizados pelo laboratório.
III.A acreditação confere credibilidade ao laboratório porque é uma forma de atestar sua competência técnica.
IV. O órgão responsável pela elaboração de Normas Técnicas no Brasil é o INMETRO.
É correto apenas o que se afirma em
A) I e III.
B) I e IV.
C) II e IV.
D) I, II e III.
E) II, III e IV.
QUESTÃO 32
ENADE 2017: Considere os seguintes resultados das análises de um composto orgânico desconhecido, de fórmula molecular C4H10O, apresentados no quadro 1, e os dados de referência apresentados no quadro 2.
Com base nos resultados e dados apresentados,
conclui-se que o composto analisado é o
A) butan-1-ol.
B) butan-2-ol.
C) 2-metilbutan-2-ol.
D) 2-metilpropan-1-ol.
E) 2-metilpropan-2-ol.
QUESTÃO 33
ENADE 2017: A Química Verde possui 12 princípios que servem como uma base norteadora para boas práticas em química, podendo promover e assessorar o desenvolvimento de políticas públicas e projetos de iniciativa privada, como o monitoramento ambiental.
O monitoramento ambiental é um processo de coleta de dados, estudo e acompanhamento contínuo e sistemático das variáveis ambientais, com o objetivo de identificar e avaliar — qualitativa e quantitativamente — as condições dos recursos naturais em determinado momento, assim como às tendências ao longo do tempo. As variáveis sociais, econômicas e institucionais também são incluídas nesse tipo de estudo, já que exercem influências sobre o meio ambiente.
Disponível em: <htto:/fwwwagencia cnptia.embrapa br>.
Acesso em: 11 set. 2017 (adaptado).
Assinale qual dos métodos de extração e/ou separação de analitos a seguir estão em maior conformidade com os princípios da Química Verde.
A) Extração por Soxhlet e extração em fase sólida (SPE).
B) Extração líquido-líquido e microextração dispersiva líquido-líquido (DLLME).
C) Permeação em membrana (EPM) e extração líquido-líquido.
D) Microextração em fase sólida (SPME) e extração em fase sólida (SPE).
E) Microextração em fase sólida (SPME) e microextração dispersiva líquido-líquido (DLLME).
QUESTÃO 34
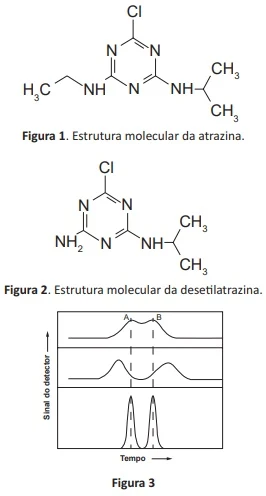
ENADE 2017: Com o objetivo de identificar e quantificar o herbicida atrazina (figura 1) e seu metabólito, a desetilatrazina (figura 2), em águas superficiais de uma bacia hidrográfica, uma pesquisadora realizou um levantamento bibliográfico para verificar que métodos a comunidade científica tem utilizado para esse fim. A pesquisadora identificou a cromatografia líquida de alta eficiência (CLAE) com detector de fluorescência como o método de escolha.
Como primeira tentativa de separação, utilizou coluna de fase reversa, eluindo os analitos em modo isocrático com fase móvel constituída de dois solventes: ácido fórmico 0,5% e acetonitrila, não obtendo resultado satisfatório, conforme mostrado na figura 3, em que os componentes “A” e “B” representam, respectivamente, a atrazina e a desetilatrazina.
SKOOG, D. A. et al. Fundamentos de química analítica. São Paulo: Thomson Learning, 2006 (adaptado).
De forma a melhorar a separação, a mencionada pesquisadora deve
A) aumentar o fluxo da fase móvel, para aumentar a eficiência da separação.
B) diminuir a polaridade da fase móvel, para aumentar a eficiência de separação.
C) mudar a fase estacionária para fase normal, com o intuito de aumentar a eficiência de separação.
D) aumentar a temperatura da coluna, com o intuito de aumentar a distribuição entre fase móvel e fase estacionária.
E) aumentar o tamanho da coluna, com o intuito de aumentar o número de pratos teóricos e aumentar a eficiência de separação.
QUESTÃO 35
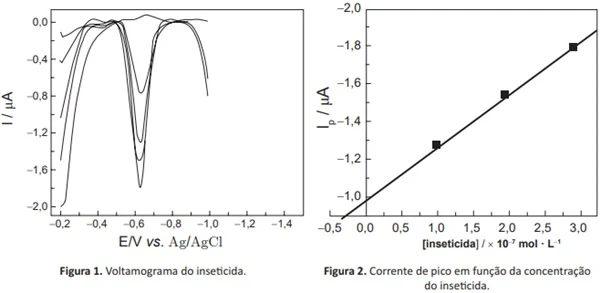
ENADE 2017: As figuras 1 e 2, apresentadas a seguir, foram extraídas de estudo sobre a determinação voltamétrica de um inseticida, em meio aquoso, empregando-se um eletrodo sólido de amálgama de prata e um fio de platina como eletrodos de trabalho e auxiliar, respectivamente. A quantificação do inseticida nas amostras foi realizada por adição padrão.
LUCCA B. G. et al. Voltammetric determination of insecticide thiodicarb through its electrochemical reduction using novel
solid amalgam electrode fabricated with silver nanoparticles. Electrochimica Acta, 246, p. 748-756, 2017 (adaptado).
A partir das informações apresentadas sobre sistema eletroquímico, assinale a opção correta.
A) O sinal voltamétrico representa a corrente que flui entre os eletrodos de referência e de trabalho.
B) Os voltamogramas apresentados na figura 1 foram obtidos usando-se a técnica de voltametria cíclica.
C) O sinal analítico é gerado na faixa de -0,2 V, com correlação linear com a concentração do inseticida.
D) O pico, na região negativa de potencial, em torno de -0,6 V, é obtido durante a redução do inseticida.
E) O sinal analítico traçado na região de concentrações negativas, na figura 2, representa uma limitação da técnica para determinação do inseticida em baixas concentrações.
LICENCIATURA
QUESTÃO 26
ENADE 2017: No ensino de Química, o modelo de bolas e varetas, que representa os átomos como esferas e as ligações como varetas, proporciona boa visão dos ângulos das ligações entre os átomos da molécula e, muitas vezes, todos os átomos são representados por bolas do mesmo tamanho. Em outros modelos, o tamanho das bolas reflete o tamanho relativo dos átomos e, em alguns outros, os símbolos dos elementos estão gravados nas bolas; há também os que identificam os átomos por diferentes cores.
BROWN, TL; LEMAY JR, H. E; BURSTEN, B. E Química: a ciência central.
7.ed. Rio de Janeiro: LTC, 1999 (adaptado).
Considerando as informações apresentadas no texto, avalie as asserções a seguir e a relação proposta entre elas.
I. O modelo de bolas e varetas contribui para o entendimento da natureza tridimensional das moléculas, ainda que se identifiquem nele limitações epistemológicas.
PORQUE
II. Apesar de fornecer uma representação correta das ligações químicas, o modelo de bolas e varetas representa, de forma reducionista, os átomos como esferas sólidas e maciças.
A respeito dessas asserções, assinale a opção correta.
A) As asserções I e II são proposições verdadeiras, e a II é uma justificativa correta da I.
B) As asserções I e II são proposições verdadeiras, mas a II não é uma justificativa correta da I.
C) A asserção I é uma proposição verdadeira, e a II é uma proposição falsa.
D) A asserção I é uma proposição falsa, e a II é uma proposição verdadeira.
E) As asserções I e II são proposições falsas.
QUESTÃO 27
ENADE 2017: Tal como um médico realiza um diagnóstico individualizado em seus pacientes, o professor pode ser capaz de identificar os problemas de aprendizagem do estudante, esforçando-se em estabelecer uma "ação terapêutica" sob medida.
PERRENOUD, . Avaliação: da Excelência à Regulação das Aprendizagens
— Entre Duas Lógicas. Tradução: RAMOS, O. C. Porto Alegre:
Artmed, 1999 (adaptado).
De acordo com o exposto, considerando características de um processo avaliativo que atenda às necessidades dos alunos, avalie as afirmações a seguir.
I. As funções tradicionais da avaliação e a estrutura escolar devem ser resguardadas, sendo prioridade da avaliação o ranqueamento dos estudantes.
II. A avaliação diagnóstica deve ser igualitária, assegurando que todos os alunos de um mesmo nível realizem os mesmos testes.
III. Uma intervenção diferenciada deve suceder à avaliação, possivelmente implicando alterações no ensino, na organização dos horários e do grupo-aula.
É correto o que se afirma em
A) I, apenas.
B) III, apenas.
C) I e II, apenas.
D) II e III, apenas.
E) I, II e III.
QUESTÃO 28
ENADE 2017: O agravamento dos problemas ambientais pós-Segunda Guerra, a tomada de consciência de muitos intelectuais com relação às questões éticas, a qualidade de vida da sociedade industrializada, a necessidade da participação popular nas decisões públicas e, sobretudo, o medo e a frustração decorrentes dos excessos tecnológicos propiciaram as condições para o surgimento de propostas de ensino CTS (Ciência — Tecnologia — Sociedade).
SANTOS, W.L. P; MORTIMER, E. F. Uma análise de pressupostos teóricos da abordagem CTS
Ciência - Tecnologia - Sociedade) no contexto da educação brasieira. Ensalo Pesquisa em Educação em Ciências, v 2, n.2, 2000(adaptado).
Assim, propostas curriculares para o Ensino de Ciências numa perspectiva que relacione Ciência, Tecnologia e Sociedade (CTS) constroem-se a partir de um novo olhar para a Ciência.
A linha de ensino CTS persegue uma lógica e uma orientação axiológica no sentido da dimensão formativa e cultural. Não confina o ensino de Ciências ao estatuto acadêmico da disciplina, aposta na Ciência para o cidadão. Valoriza a construção de saberes vinculados à solução prática de problemas do cidadão e à mobilização do cidadão para lidar com saberes indispensáveis a decisões, vigilâncias e denúncias oportunas.
SANTOS, M. E. N. V. M. A dimensão CTS do ensino das Ciências: fundamentos, contextos e desafios. In: MACIEL, M. D;; AMARAL, C.L. C.;
GUAZZELU, |. R. B Ciência, tecnologia e sociedade: pesquisa e ensino. São Paulo: Terracota, 2010 (adaptado).
A partir dos textos apresentados, avalie as asserções a seguir e a relação proposta entre elas.
I. Nas propostas curriculares de CTS, os conteúdos científicos e tecnológicos são estudados juntamente com a discussão de seus aspectos históricos, éticos, políticos e socioeconômicos.
PORQUE
II. Essas propostas não se limitam a apresentar os avanços científicos e tecnológicos, disponibilizando, também, informações e fomentando discussões que permitam ao cidadão agir e compreender o que está em jogo no discurso dos especialistas.
A respeito dessas asserções, assinale a opção correta.
A) As asserções I e II são proposições verdadeiras, e a II é uma justificativa correta da I.
B) As asserções I e II são proposições verdadeiras, mas a II não é uma justificativa correta da I.
C) A asserção I é uma proposição verdadeira, e a II é uma proposição falsa.
D) A asserção I é uma proposição falsa, e a II é uma proposição verdadeira.
E) As asserções I e II são proposições falsas.
QUESTÃO 29
ENADE 2017: No ano de 2009, os legisladores da Câmara de Educação Básica do Conselho Nacional de Educação, por meio de políticas nacionais de inclusão escolar, instituíram as Diretrizes Operacionais para o Atendimento Educacional Especializado na Educação Básica, com base no documento final da Declaração de Salamanca (1994), em que governantes e delegados, representando 88 governos e 25 organizações internacionais, em assembleia, reafirmaram a estrutura de ação em educação especial a seguir.
“O princípio que orienta essa estrutura é o de que escolas deveriam acomodar todas as crianças independentemente de suas condições físicas, intelectuais, sociais, emocionais, linguísticas ou outras.
Deveriam incluir crianças deficientes e superdotadas, crianças de rua e que trabalham, crianças de origem remota ou de população nômade, crianças pertencentes a minorias linguísticas, étnicas ou culturais e crianças de outros grupos desavantajados ou marginalizados. Tais condições geram uma variedade de diferentes desafios aos sistemas escolares. No contexto dessa estrutura, o termo necessidades educacionais especiais refere-se a todas aquelas crianças ou jovens cujas necessidades educacionais especiais se originam em função de deficiências ou dificuldades de aprendizagem”.
Disponível em: <http;//portal.mec.govbr>. Acesso em: 11 jul. 2017 (adaptado).
Com base nas Diretrizes Operacionais para o Atendimento Educacional Especializado na Educação Básica e na Declaração de Salamanca (1994), conclui-se que, nas aulas de ensino inclusivo de química, o professor deve
A) respeitar a dificuldade do aluno pertencente ao público alvo da educação especial, planejando e elaborando atividades diferentes em consonância com as limitações impostas por sua condição, o que facilita o seu processo de inclusão escolar.
B) estar preparado para lidar com as diferentes necessidades de aprendizagem de cada aluno, inclusive com as dos estudantes com deficiência.
C) respeitar a dificuldade do aluno pertencente ao público alvo da educação especial, planejando e elaborando avaliações simplificadas e individualizadas.
D) delegar ao aluno pertencente ao público alvo da educação especial a responsabilidade por definir os parâmetros de sua própria avaliação.
E) evitar atividades que demandem a adaptação pedagógica ou a utilização de tecnologias assistivas para atendimento educacional especializado.
QUESTÃO 30
ENADE 2017: O cartum apresentado faz referência ao princípio de incerteza, formulado por W. Heisenberg. De acordo com esse princípio, é impossível observar um fenômeno sem, ao mesmo tempo, nele interferir. Em relação aos modelos atômicos, a principal consequência desse princípio é
A) a descoberta do efeito fotoelétrico.
B) a explicação do fenômeno da radioatividade.
C) a descoberta das linhas discretas no espectro do hidrogênio.
D) o abandono do modelo de J. J. Thomson e a adoção do átomo nucleado.
E) o abandono da ideia de órbitas fixas para os elétrons e a adoção do conceito de orbitais.



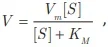










COMENTÁRIOS